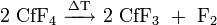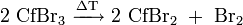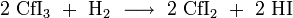- Kalifornium
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Californium, Cf, 98 Serie Actinoide Gruppe, Periode, Block Ac, 7, f Aussehen silbriges Metall CAS-Nummer 7440-71-3 Massenanteil an der Erdhülle 0 % Atomar [1] Atommasse 251 u Atomradius (berechnet) 186 ± 2 pm[2] () pm Kovalenter Radius 225 pm Elektronenkonfiguration [Rn] 5f107s2 Elektronen pro Energieniveau 2, 8, 18, 32, 28, 8, 2 1. Ionisierungsenergie 608 kJ/mol Physikalisch [1] Aggregatzustand fest Kristallstruktur hexagonal Dichte 15,1 g/cm3 Schmelzpunkt 1173 K (900 °C) Siedepunkt K ( °C) Molares Volumen 16,50 · 10−6 m3/mol Chemisch [1] Oxidationszustände (+2), +3, (+4) Oxide (Basizität) Normalpotential −1,910 V
(Cf3+ + 3 e− → Cf)[2]Elektronegativität 1,30 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 244Cf 19,4 min α (≈ 100 %) 240Cm 245Cf 45 min ε (64 %) 245Bk α (36 %) 241Cm 246Cf 35,7 h α (≈ 100 %) 242Cm SF (2,5 · 10−4 %) ? ? ε (< 4 · 10−3 %) 246Bk 247Cf 3,11 h ε (≈ 100 %) 0,646 247Bk α (0,035 %) 6,527 243Cm 248Cf 334 d α (≈ 100 %) 6,361 244Cm SF (0,0029 %) ? ? 249Cf 351 a α (≈ 100 %) 6,295 245Cm SF (5,0 · 10−7 %) ? ? 250Cf 13,08 a α (≈ 100 %) 6,128 246Cm SF (0,077 %) ? ? 251Cf 900 a α (≈ 100 %) 6,176 247Cm SF (?) ? ? 252Cf 2,645 a α (96,908 %) 6,217 248Cm SF (3,092 %) ? ? 253Cf 17,81 d β− (≈ 100 %) 0,285 253Es α (0,31 %) 6,124 249Cm 254Cf 60,5 d SF (≈ 100 %) ? ? α (0,31 %) 5,926 250Cm Sicherheitshinweise Gefahrstoffkennzeichnung [4] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben weitere Sicherheitshinweise Radioaktivität
Radioaktives ElementSoweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Californium, gelegentlich auch Kalifornium geschrieben, ist ein chemisches Element mit dem Symbol Cf und der Ordnungszahl 98 im Periodensystem der Elemente. Auf der Erde gibt es keine natürlichen Vorkommen, es kann nur künstlich erzeugt werden. Californium gehört zur Gruppe der Actinoide (7. Periode, f-Block) und zählt auch zu den Transuranen. Benannt wurde es nach der Universität von Kalifornien und dem US-amerikanischen Bundesstaat Kalifornien, wo es entdeckt wurde.
Bei Californium handelt es sich um ein radioaktives Metall. Es wurde im Februar 1950 erstmals aus dem leichteren Element Curium erzeugt.
Es entsteht in geringen Mengen in Kernreaktoren. Seine Anwendung findet es vor allem für mobile und tragbare Neutronenquellen.
Inhaltsverzeichnis
Geschichte
So wie Americium (Ordnungszahl 95) und Curium (96) in den Jahren 1944 und 1945 nahezu zeitgleich entdeckt wurden, erfolgte in ähnlicher Weise in den Jahren 1949 und 1950 die Entdeckung der Elemente Berkelium (97) und Californium (98).
Californium wurde zum ersten Mal am 9. Februar 1950 an der Universität von Californien in Berkeley von Stanley G. Thompson, Kenneth Street, Jr., Albert Ghiorso und Glenn T. Seaborg erzeugt, indem sie Atomkerne des Curiums mit α-Teilchen beschossen. Es war das sechste Transuran, das entdeckt wurde. Die Entdeckung wurde zeitgleich mit der des Berkeliums veröffentlicht.[5][6][7]
Die Namenswahl für beide Elemente folgte demselben Muster: Während Berkelium zu Ehren der Universität von Berkeley seinen Namen erhielt, wählte man für das Element 98 den Namen Californium zu Ehren der Universität und des Staates Kalifornien: It is suggested that element 98 be given the name californium (symbol Cf) after the university and state where the work was done. This name, chosen for the reason given, does not reflect the observed chemical homology of element 98 to dysprosium (No. 66) as the names americium (No. 95), curium (No. 96), and berkelium (No. 97) signify that these elements are the chemical homologs of europium (No. 63), gadolinium (No. 64), and terbium (No. 65), respectively.[6]
Die Probenvorbereitung erfolgte zunächst durch Auftragen von Curiumnitratlösung (mit dem Isotop 242Cm) auf eine Platinfolie von etwa 0,5 cm2; die Lösung wurde eingedampft und der Rückstand dann zum Oxid (CmO2) geglüht.
Nun wurde diese Probe im 60-Inch-Cyclotron mit beschleunigten α-Teilchen mit einer Energie von 35 MeV etwa 2–3 Stunden beschossen. Dabei entsteht in einer sogenannten (α,n)-Reaktion 245Cf und ein freies Neutron:
Nach dem Beschuss im Cyclotron wurde die Beschichtung mittels Salpetersäure gelöst, anschließend wieder mit einer konzentrierten wässrigen Ammoniak-Lösung als Hydroxid ausgefällt; der Rückstand wurde in Perchlorsäure gelöst.
Die weitere Trennung erfolgte in Gegenwart eines Citronensäure/Ammoniumcitrat-Puffers im schwach sauren Medium (pH ≈ 3,5) mit Ionenaustauschern bei erhöhter Temperatur.
Die chromatographische Trennung konnte nur aufgrund vorheriger Vergleiche mit dem chemischen Verhalten der entsprechenden Lanthanoide gelingen. So tritt bei einer Trennung das Dysprosium vor Terbium, Gadolinium und Europium aus einer Säule. Falls das chemische Verhalten des Californiums dem eines Eka-Dysprosiums ähnelt, sollte das fragliche Element 98 daher in dieser analogen Position zuerst erscheinen, entsprechend vor Berkelium, Curium und Americium.
Die Experimente zeigten ferner, dass nur die Oxidationsstufe +3 zu erwarten war. Entsprechende Oxidationsversuche mit Ammoniumperoxodisulfat beziehungsweise Natriumbismutat zeigten, dass entweder höhere Oxidationsstufen in wässrigen Lösungen nicht stabil sind oder eine Oxidation selbst zu langsam verläuft.
Die zweifelsfreie Identifikation gelang, als die vorherberechnete charakteristische Energie (7,1 MeV) des beim Zerfall ausgesandten α-Teilchens experimentell gemessen werden konnte. Die Halbwertszeit dieses α-Zerfalls wurde erstmals auf 45 Minuten bestimmt.
In der Erstveröffentlichung ging man zunächst davon aus, das Californiumisotop mit der Massenzahl 244 gemäß folgender Gleichung erzeugt zu haben:
Im Jahr 1956 wurde diese Hypothese korrigiert: Der 45-Minuten α-Strahler, der zunächst dem Isotop 244Cf zugeordnet wurde, wurde neu auf die Massenzahl 245 festgelegt, festgestellt unter anderem durch Langzeitbeschuss und Zerfallsstudien. 245Cf zerfällt sowohl durch die Emission von α-Teilchen (7,11 ± 0,02 MeV) (~ 30 %) als auch durch Elektroneneinfang (~ 70 %). Das neue Isotop 244Cf wurde auch ermittelt und dabei festgestellt, dass sein Zerfall durch die Emission eines α-Teilchens stattfindet (7,17 ± 0,02 MeV mit einer Halbwertszeit von 25 ± 3 Minuten). Die Massenzuordnung dieses Isotops ergab sich durch das Auffinden des Curiumisotops 240Cm. Das 244Cf entsteht durch (α,4n)-Reaktion aus 244Cm:[8]
Im Jahr 1958 isolierten Burris B. Cunningham und Stanley G. Thompson erstmals wägbare Mengen eines Gemisches der Isotope 249Cf, 250Cf, 251Cf, 252Cf, die durch langjährige Neutronenbestrahlung von 239Pu in dem Testreaktor der National Reactor Testing Station in Idaho erzeugt wurden.[9] 1960 isolierten B. B. Cunningham und J. C. Wallmann die erste Verbindung des Elements, etwa 0,3 µg CfOCl, und anschließend das Oxid Cf2O3 und das Trichlorid CfCl3.[10][2]
Isotope
Von Californium gibt es 20 durchweg radioaktive Isotope und ein Kernisomer (Massenzahlen von 237 bis 256). Die langlebigsten sind 251Cf (Halbwertszeit 900 Jahre), 249Cf (351 Jahre), 250Cf (13 Jahre), 252Cf (2,645 Jahre) und 248Cf (334 Tage). Die Halbwertszeiten der restlichen Isotope liegen im Bereich von Millisekunden bis Stunden oder Tagen.[3]
Die Isotope 249Cf und 251Cf sind spaltbar.
Nimmt man beispielhaft den Zerfall des langlebigsten Isotops 251Cf heraus, so entsteht durch α-Zerfall zunächst das langlebige 247Cm, das seinerseits durch erneuten α-Zerfall in 243Pu übergeht. Der weitere Zerfall führt dann über 243Am, 239Np, 239Pu zum 235U, dem Beginn der Uran-Actinium-Reihe (4 n + 3).
- Die angegebenen Zeiten sind Halbwertszeiten.
Das Isotop 252Cf zerfällt bei einer Halbwertszeit von 2,645 Jahren zu 96,908 %[3] durch α-Zerfall, aber auch zu 3,092 %[3] durch Spontanspaltung[11][12][13] und emittiert dabei 3,77 Neutronen[14][15]. Es wird daher als Neutronenquelle verwendet.
Das Isotop 254Cf zerfällt bei einer Halbwertszeit von 60,5 Tagen fast ausschließlich durch Spontanspaltung.[3]
Vorkommen
Das langlebigste Isotop 251Cf besitzt eine Halbwertszeit von 900 Jahren. Aus diesem Grund ist das gesamte primordiale Californium, das die Erde bei ihrer Entstehung enthielt, mittlerweile zerfallen.
In den Überresten der ersten amerikanischen Wasserstoffbombe wurden am 1. November 1952 auf dem Eniwetok-Atoll – neben der Erstentdeckung von Einsteinium und Fermium und dem Nachweis von Plutonium und Americium – auch Isotope von Curium, Berkelium und Californium gefunden: vor allem die Isotope 245Cm und 246Cm, in kleineren Mengen 247Cm und 248Cm, in Spuren 249Cm; ferner 249Bk, 249Cf, 252Cf, 253Cf und 254Cf. Die Menge des 249Cf stieg durch den β-Zerfall des 249Bk an (Halbwertszeit 330 Tage). Es wurde dagegen kein 250Cf gefunden. Dies lässt sich darauf zurückführen, dass die Halbwertszeit von 250Cm mit rund 8300 Jahren[3] zu groß ist, als dass durch β-Zerfall (über 250Bk) detektierbare Mengen 250Cf hätten gebildet werden können. Zudem zerfällt 250Cm nur mit einer Wahrscheinlichkeit von rund 6 % im β-Zerfall zu 250Bk.[3] Wohl auch aus Gründen der militärischen Geheimhaltung wurden die Ergebnisse erst im Jahr 1956 publiziert.[16]
Es wurde in den 1950er Jahren vermutet, dass Californiumisotope im r-Prozess in Supernovae entstehen. Besonderes Interesse fand hierbei das Isotop 254Cf, welches zuvor in den Überresten der ersten amerikanischen Wasserstoffbombe gefunden wurde. Mit der damals gemessenen Halbwertszeit für die Spontanspaltung von 56,2 ± 0,7 Tagen[17] (aktuell: 60,5 Tage[3]) vermutete man eine Übereinstimmung mit dem Verlauf der Lichtkurve von Supernovae des Typs I von 55 ± 1 Tagen.[18][19][20][21] Der Zusammenhang ist allerdings immer noch fraglich.
In Kernreaktoren entstehen vor allem die langlebigen α-strahlenden Isotope 249Cf und 251Cf. Sie zählen wegen ihrer langen Halbwertszeit zum Transuranabfall und sind bei der Endlagerung besonders problematisch.
Gewinnung und Darstellung
Gewinnung von Californiumisotopen
Californium entsteht in Kernreaktoren aus Uran 238U oder Plutoniumisotopen durch zahlreiche nacheinander folgende Neutroneneinfänge und β-Zerfälle – unter Ausschluss von Spaltungen oder α-Zerfällen –, die über Berkelium zu den Californiumisotopen führen, so zuerst die Isotope mit den Massenzahlen 249, 250, 251 und 252.[22][23]
Ein wichtiger Schritt ist hierbei die (n,γ)- oder Neutroneneinfangsreaktion, bei welcher das gebildete angeregte Tochternuklid durch Aussendung eines γ-Quants in den Grundzustand übergeht. Die hierzu benötigten freien Neutronen entstehen durch Kernspaltung anderer Kerne im Reaktor. In diesem kernchemischen Prozess wird zunächst durch eine (n,γ)-Reaktion gefolgt von zwei β−-Zerfällen das Plutoniumisotop 239Pu gebildet. In Brutreaktoren wird dieser Prozess zum Erbrüten neuen Spaltmaterials genutzt.
![\mathrm{^{238}_{\ 92}U\ \xrightarrow {(n,\gamma)} \ ^{239}_{\ 92}U\ \xrightarrow [23,5 \ min]{\beta^-} \ ^{239}_{\ 93}Np\ \xrightarrow [2,3565 \ d]{\beta^-} \ ^{239}_{\ 94}Pu}](/pictures/dewiki/101/edb02ee4f5bdfb392e8d175f1bd8cf39.png)
- Die angegebenen Zeiten sind Halbwertszeiten.
Letzteres wird hierzu mit einer Neutronenquelle, die einen hohen Neutronenfluss besitzt, bestrahlt. Die hierbei möglichen Neutronenflüsse sind um ein vielfaches höher als in einem Kernreaktor. Aus 239Pu wird durch vier aufeinander folgende (n,γ)-Reaktionen 243Pu gebildet, welches durch β-Zerfall mit einer Halbwertszeit von 4,96 Stunden zu dem Americiumisotop 243Am zerfällt. Das durch eine weitere (n,γ)-Reaktion gebildete 244Am zerfällt wiederum durch β-Zerfall mit einer Halbwertszeit von 10,1 Stunden letztlich zu 244Cm. Aus 244Cm entstehen durch weitere (n,γ)-Reaktionen im Reaktor in jeweils kleiner werdenden Mengen die nächst schwereren Isotope.
Die Entstehung von 250Cm auf diesem Wege ist jedoch sehr unwahrscheinlich, da 249Cm nur eine kurze Halbwertszeit besitzt und so weitere Neutroneneinfänge in der kurzen Zeit unwahrscheinlich sind.
249Cf ist das erste Isotop des Californiums, das auf diese Weise gebildet werden kann. Es entsteht durch zweimaligen β-Zerfall aus 249Cm – das erste Curiumisotop, welches einen β-Zerfall eingeht (Halbwertszeit 64,15 min[3]).
Das hier entstehende 249Bk bildet zudem durch Neutroneneinfang das 250Bk, welches mit einer Halbwertszeit von 3,212 Stunden[3] durch β-Zerfall zum Californiumisotop 250Cf zerfällt.[24][25]
Durch weitere Neutroneneinfänge werden die Isotope 251Cf, 252Cf und 253Cf aufgebaut. Nach einjähriger Bestrahlung stellt sich folgende Isotopenverteilung ein: 249Cf (2 %), 250Cf (15 %), 251Cf (4 %) und 252Cf (79 %).[26] Das Isotop 253Cf zerfällt schon mit einer Halbwertszeit von 17,81 Tagen zu 253Es.
Californium steht (zumeist als Oxid Cf2O3) heute weltweit lediglich in sehr geringen Mengen zur Verfügung, weshalb es einen sehr hohen Preis besitzt. Dieser beträgt etwa 160 US-Dollar pro Mikrogramm 249Cf bzw. 50 US-Dollar für 252Cf.[27]
Californium (244Cf und 246Cf) wurde erstmals 1951 auch aus Uran durch Beschuss mit Kohlenstoff gewonnen:[28]
Die leichteren Isotope des Californiums (240Cf und 241Cf) wurden durch Beschuss von 235U, 234U und 233U mit Kohlenstoff im Jahr 1970 erzeugt.[29]
Darstellung elementaren Californiums
Californium erhält man durch Reduktion von Californium(III)-oxid oder -fluorid mit Lanthan oder Thorium.
Im Jahr 1974 wurde berichtet, dass Californium erstmals in metallischer Form (wenige Mikrogramm) durch Reduktion von Californium(III)-oxid (Cf2O3) mit Lanthan gewonnen und das Metall in Form dünner Filme auf Trägern für die Elektronenmikroskopie aufgebracht wurde. Aufgrund der Messungen wurden zunächst eine f.c.c.-Struktur (a = 574,3 ± 0,6 pm) und eine hexagonale Struktur (a = 398,8 ± 0,4 pm und c = 688,7 ± 0,8 pm) beschrieben. Der Schmelzpunkt wurde erstmals mit 900 ± 30 °C gemessen.[30] Diese Ergebnisse wurden allerdings im Folgejahr 1975 in Frage gestellt. Die beiden Phasen des Californiums wurden stattdessen als Verbindungen dieses Metalls beschrieben: die hexagonale Phase als Cf2O2S, die f.c.c.-Phase als CfS. In beiden Verbindungen wird eine Dreiwertigkeit des Californiums mit einem Atomradius von 183–185 pm beschrieben.[31]
Eigenschaften
Physikalische Eigenschaften
Bei Californium handelt es sich um ein künstliches, radioaktives Metall mit einem Schmelzpunkt von ca. 900 °C und einer Dichte von 15,1 g/cm3. Es tritt in drei Modifikationen auf: α-, β- und γ-Cf.
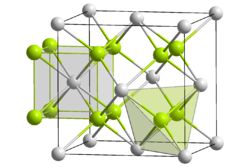
Das bei Standardbedingungen auftretende α-Cf (< 600 °C) kristallisiert im hexagonalen Kristallsystem in der Raumgruppe
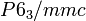 mit den Gitterparametern a = 338 pm und c = 1102,5 pm sowie vier Formeleinheiten pro Elementarzelle.[32][33] Die Kristallstruktur besteht aus einer doppelt-hexagonal dichtesten Kugelpackung (d.h.c.p.) mit der Schichtfolge ABAC und ist damit isotyp zur Struktur von α-La.
mit den Gitterparametern a = 338 pm und c = 1102,5 pm sowie vier Formeleinheiten pro Elementarzelle.[32][33] Die Kristallstruktur besteht aus einer doppelt-hexagonal dichtesten Kugelpackung (d.h.c.p.) mit der Schichtfolge ABAC und ist damit isotyp zur Struktur von α-La.Unter hohem Druck geht α-Cf allmählich in β-Cf über.[34] Die β-Modifikation (600–725 °C) kristallisiert im kubischen Kristallsystem in der Raumgruppe
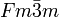 mit dem Gitterparameter a = 494 pm, was einem kubisch flächenzentrierten Gitter (f.c.c.) beziehungsweise einer kubisch dichtesten Kugelpackung mit der Stapelfolge ABC entspricht.[32] Oberhalb von 725 °C wandelt sich die β-Modifikation in die γ-Modifikation um. Die γ-Modifikation kristallisiert ebenfalls im kubischen Kristallsystem, jedoch mit einem größeren Gitterparameter von a = 575 pm.[32]
mit dem Gitterparameter a = 494 pm, was einem kubisch flächenzentrierten Gitter (f.c.c.) beziehungsweise einer kubisch dichtesten Kugelpackung mit der Stapelfolge ABC entspricht.[32] Oberhalb von 725 °C wandelt sich die β-Modifikation in die γ-Modifikation um. Die γ-Modifikation kristallisiert ebenfalls im kubischen Kristallsystem, jedoch mit einem größeren Gitterparameter von a = 575 pm.[32]Die Lösungsenthalpie von Californium-Metall (d.h.c.p.) in Salzsäure (bei Standardbedingungen) beträgt −576,1 ± 3,1 kJ·mol−1. Ausgehend von diesem Wert erfolgte die erstmalige Berechnung der Standardbildungsenthalpie (ΔfH0) von Cf3+(aq) auf −577 ± 5 kJ·mol−1 und des Standardpotentials Cf3+ / Cf0 auf −1,92 ± 0,03 V.[35][36]
Chemische Eigenschaften
Das silberglänzende Schwermetall ist wie alle Actinoide sehr reaktionsfähig. Es wird von Wasserdampf, Sauerstoff und Säuren angegriffen; gegenüber Alkalien ist es stabil.[2]
Die stabilste Oxidationsstufe ist die für die höheren Actinoide zu erwartende Stufe +3. Es bildet dabei zwei Reihen von Salzen: Cf3+- und CfO+-Verbindungen.
Auch die zweiwertige und vierwertige Stufe ist bekannt. Cf(II)-Verbindungen sind starke Reduktionsmittel. In Wasser setzen sie unter Oxidation zu Cf3+ Wasserstoff frei. Californium(IV)-Verbindungen sind starke Oxidationsmittel. Sie sind instabiler als die von Curium und Berkelium. In fester Form sind bisher nur zwei Verbindungen des Californiums in der Oxidationsstufe +4 bekannt: Californium(IV)-oxid (CfO2) und Californium(IV)-fluorid (CfF4). Californium(IV)-fluorid gibt beim Erhitzen elementares Fluor ab.
Wässrige Lösungen mit Cf3+-Ionen haben eine grüne Farbe, mit Cf4+-Ionen sind sie braun.[37]
Cf4+-Ionen sind in wässriger Lösung im Unterschied zu den Cf3+-Ionen nicht stabil und können nur komplexstabilisiert vorliegen. Eine Oxidation des dreiwertigen Californiums (249Cf) gelang in Kaliumcarbonat-Lösung (K2CO3) an einer Platinanode. Während der Elektrolyse konnte die Zunahme einer Breitbandabsorption im Bereich von λ < 500 nm beobachtet werden (Gelbfärbung der Lösung); die Absorptionsbande des Californium(III) nahm entsprechend ab. Eine vollständige Oxidation konnte nicht erreicht werden.[38][39]
Spaltbarkeit
Generell sind alle Californium-Isotope mit Massenzahlen zwischen 249 und 254 in der Lage, eine Kettenreaktion mit Spaltneutronen aufrecht zu erhalten. Für die anderen Isotope reichen die öffentlich bekannten Daten zur Berechnung derzeit (1/2009) nicht aus.[40][41] Mit thermischen Neutronen gelingt eine Kettenreaktion bei den Isotopen 249, 251, 252, 253 und evtl. 254. Bei letztgenanntem sind die Unsicherheiten der derzeitigen Daten für eine genaue Beurteilung zu groß (1/2009).[42]
Das Isotop 251Cf verfügt über eine sehr kleine kritische Masse von lediglich 5,46 kg für eine reine Kugel, die mit Reflektor bis auf 2,45 kg reduziert werden kann. Dadurch wurden Spekulationen ausgelöst, dass es möglich wäre, enorm kleine Atombomben zu bauen. Erschwert wird dies aber neben der sehr geringen Verfügbarkeit und dem damit einhergehenden hohen Preis auch durch die kurze Halbwertszeit von 251Cf und der daraus resultierenden hohen Wärmeabgabe. Die kritische Masse von 254Cf liegt zwar mit etwa 4,3 kg noch unter der von 251Cf, allerdings ist die Herstellung dieses Isotops bedeutend aufwändiger und die Halbwertszeit von 60,5 Tagen zu kurz für eine Verwendung in Kernwaffen.[42]
Weiterhin würden sich die Isotope 249Cf, 251Cf und 252Cf auch zum Betreiben eines Kernreaktors eignen. In wässriger Lösung mit Reflektor sinkt die kritische Masse von 249Cf auf etwa 51 g, die von 251Cf sogar auf lediglich rund 20 g. Alle drei Isotope könnten auch in einem schnellen Reaktor eingesetzt werden. Dieser könnte darüber hinaus auch mit 250Cf realisiert werden (kritische Masse: 6,55 kg unreflektiert).[42] Dem stehen aber auch hier die geringe Verfügbarkeit und der hohe Preis entgegen, weshalb bislang keine Reaktoren auf Californiumbasis gebaut wurden. Dementsprechend wird Californium im deutschen Atomgesetz nicht als Kernbrennstoff geführt.[43]
Verwendung
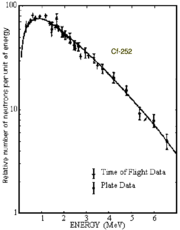 Das Spektrum der von 252Cf emittierten Neutronen.[44]
Das Spektrum der von 252Cf emittierten Neutronen.[44]Neutronenquelle
Am interessantesten ist das Isotop 252Cf. Es zerfällt zum Teil durch Spontanspaltung[3]; 1 µg strahlt dabei pro Sekunde 2,314 Millionen Neutronen ab[45]. Es wird daher ausschließlich für mobile, tragbare und dabei starke Neutronenquellen eingesetzt; dabei wird es in Form von Californium(III)-oxid (Cf2O3) bereitgestellt.
Als Neutronenquelle wird es für Folgendes verwendet:
- in der Medizin zur Krebsbehandlung[46][47]
- in der Industrie (Materialdiagnostik, "On the Spot" Neutronenaktivierungsanalyse)[48]
- zur Feuchtemessung bei Bohrungen nach Erdöl (Unterscheidung von Wasser und ölführenden Schichten)[46]
- zum Auffinden von Sprengstoffen[46]
- als Anfahrquelle in Kernreaktoren[49]
Herstellung anderer Elemente
Durch Beschuss von 249Cf mit Kohlenstoff kann beispielsweise Nobelium erzeugt werden:[50]
Im Oktober 2006 wurde bekanntgegeben, dass durch den Beschuss von 249Cf mit 48Ca das bisher schwerste Element Ununoctium (Element 118) erzeugt wurde[51], nachdem eine früher bekanntgegebene Entdeckung wieder zurückgezogen worden war.
Verbindungen
- → Kategorie: Californiumverbindung
Oxide
Von Californium existieren Oxide der Oxidationsstufen +3 (Cf2O3) und +4 (CfO2).
- Californium(IV)-oxid (CfO2) entsteht durch Oxidation mit molekularem Sauerstoff bei hohem Druck und durch atomaren Sauerstoff. Es entsteht unter anderem implizit in Kernreaktoren beim Bestrahlen von Urandioxid (UO2) bzw. Plutoniumdioxid (PuO2) mit Neutronen. Es ist ein schwarzbrauner Feststoff und kristallisiert – wie die anderen Actinoiden(IV)-oxide – im kubischen Kristallsystem in der Fluorit-Struktur. Der Gitterparameter beträgt 531,0 ± 0,2 pm.[52]
- Californium(III)-oxid (Cf2O3)[53] ist ein gelbgrüner Feststoff mit einem Schmelzpunkt von 1750 °C.[54] Es gibt zwei Modifikationen; die Übergangstemperatur zwischen dem kubisch-raumzentrierten und dem monoklinen Cf2O3 beträgt etwa 1400 °C.[52] Seine Anwendung findet es vor allem bei der Herstellung von 252Cf-Neutronenquellen. Dazu wird 252Cf(III) zunächst als Californiumoxalat (Cf2(C2O4)3) gefällt, getrocknet und anschließend zum dreiwertigen Oxid geglüht.[55]
Übergangszusammensetzungen von Oxiden der Form CfOx (2,00 > x > 1,50) besitzen eine rhomboedrische Struktur.[52]
Oxihalogenide
- Californium(III)-oxifluorid (CfOF) wurde durch Hydrolyse von Californium(III)-fluorid (CfF3) bei hohen Temperaturen dargestellt. Es kristallisiert wie das Californium(IV)-oxid (CfO2) im kubischen Kristallsystem in der Fluorit-Struktur, wobei hier die Sauerstoff- und Fluoratome in zufälliger Verteilung auf den Anionenpositionen zu finden sind. Der Gitterparameter beträgt 556,1 ± 0,4 pm.[56]
- Californium(III)-oxichlorid (CfOCl) wurde durch Hydrolyse des Hydrats von Californium(III)-chlorid (CfCl3) bei 280–320 °C dargestellt. Es besitzt eine tetragonale Struktur vom PbFCl-Typ.[53]
Halogenide
Halogenide sind für die Oxidationsstufen +2, +3 und +4 bekannt.[57] Die stabilste Stufe +3 ist für sämtliche Verbindungen von Fluor bis Iod bekannt und auch in wässriger Lösung stabil. Die zwei- und vierwertige Stufe ist nur in der festen Phase stabilisierbar.
Oxidationszahl F Cl Br I +4 Californium(IV)-fluorid
CfF4
hellgrün+3 Californium(III)-fluorid
CfF3
gelbgrünCalifornium(III)-chlorid
CfCl3
grünCalifornium(III)-bromid
CfBr3
grünCalifornium(III)-iodid
CfI3
zitronengelb+2 Californium(II)-chlorid[58]
CfCl2
cremefarbenCalifornium(II)-bromid[59]
CfBr2
bernsteinfarbenCalifornium(II)-iodid
CfI2
violett- Californium(III)-fluorid (CfF3) ist ein gelbgrüner Feststoff und besitzt zwei kristalline Strukturen, die temperaturabhängig sind. Bei niedrigen Temperaturen ist die orthorhombische Struktur vom YF3-Typ zu finden. Bei höheren Temperaturen bildet es ein trigonales System vom LaF3-Typ.[60]
- Californium(IV)-fluorid (CfF4) ist ein hellgrüner Feststoff und kristallisiert entsprechend dem monoklinen UF4-Typ.[61] Californium(IV)-fluorid gibt beim Erhitzen elementares Fluor ab.
- Californium(III)-chlorid (CfCl3) ist ein grüner Feststoff und bildet zwei kristalline Modifikationen:[62] die hexagonale Form (UCl3-Typ), wobei das Cf-Atom 9-fach koordiniert ist, sowie die orthorhombische Form (PuBr3-Typ) mit der Koordinationszahl 8.
- Californium(III)-bromid (CfBr3) ist ein grüner Feststoff.[63] Es konnte nur die monokline Struktur des AlCl3-Typs nachgewiesen werden. Bei zunehmenden Temperaturen zersetzt es sich teilweise zum Californium(II)-bromid (CfBr2):[64]
- Californium(II)-iodid (CfI2) und Californium(III)-iodid (CfI3) konnten in Mikrogramm-Mengen im Hochvakuum hergestellt werden. Diese Verbindungen wurden sowohl durch Röntgenbeugung als auch durch Spektroskopie im sichtbaren Bereich charakterisiert.[65][66]
- CfI3 ist ein zitronengelber bis hellgrüner Feststoff und zeigt eine rhomboedrische Struktur vom BiI3-Typ. Das Triiodid sublimiert bei ~ 800 °C ohne zu schmelzen und kann bei 500 °C aus Cf(OH)3 und Iodwasserstoff HI dargestellt werden.[67]
- CfI2 ist ein tiefvioletter Feststoff und wird aus CfI3 durch Reduktion mit H2 bei 560 °C dargestellt:[67]
Pentelide
Die Pentelide des Californiums des Typs CfX sind für die Elemente Stickstoff, Arsen und Antimon dargestellt worden. Sie kristallisieren im NaCl-Gitter mit den Gitterkonstanten 580,9 pm für CfAs und 616,6 pm für CfSb.[68][69]
Metallorganische Verbindungen
Tricyclopentadienylkomplexe der Elemente Berkelium (Cp3Bk) und Californium (Cp3Cf) sind aus der dreiwertigen Stufe erhältlich. Die hohe Radioaktivität bewirkt allerdings eine schnelle Zerstörung der Verbindungen.[70][71]
Einzelnachweise
- ↑ Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Californium) entnommen.
- ↑ a b c d Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3, S. 139–142.
- ↑ a b c d e f g h i j k G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: "The NUBASE evaluation of nuclear and decay properties", in: Nuclear Physics A 729, 2003, 3–128.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ S. G. Thompson, K. Street, Jr., A. Ghiorso, G. T. Seaborg: "Element 98", in: Physical Review 1950, 78 (3), 298–299; doi:10.1103/PhysRev.78.298.2; Maschinoskript (27. Februar 1950).
- ↑ a b c S. G. Thompson, K. Street, Jr., A. Ghiorso, G. T. Seaborg: "The New Element Californium (Atomic Number 98)", in: Physical Review 1950, 80 (5), 790–796; doi:10.1103/PhysRev.80.790; Abstract; Maschinoskript (19. Juni 1950).
- ↑ K. Street, Jr., S. G. Thompson, G. T. Seaborg: "Chemical Properties of Californium", in: J. Am. Chem. Soc. 1950, 72 (10), 4832–4835; doi:10.1021/ja01166a528; Druck der United States Atomic Energy Commission (12. Juni 1950).
- ↑ Alfred Chetham-Strode, Jr., Gregory R. Choppin, Bernard G. Harvey: "Mass Assignment of the 44-Minute Californium-245 and the New Isotope Californium-244", in: Physical Review 1956, 102 (3), 747–748; doi:10.1103/PhysRev.102.747.
- ↑ S. G. Thompson, B. B. Cunningham: "First Macroscopic Observations of the Chemical Properties of Berkelium and Californium", supplement to Paper P/825 presented at the Second Intl. Conf., Peaceful Uses Atomic Energy, Geneva, 1958.
- ↑ Darleane C. Hoffman, Albert Ghiorso, Glenn Theodore Seaborg: The Transuranium People: The Inside Story, Imperial College Press, 2000, ISBN 978-1-86094-087-3, S. 141–142; (Google Books).
- ↑ Donald A. Hicks, John Ise, Jr., Robert V. Pyle: "Multiplicity of Neutrons from the Spontaneous Fission of Californium-252", in: Physical Review 1955, 97 (2), 564–565; doi:10.1103/PhysRev.97.564.
- ↑ Donald A. Hicks, John Ise, Jr., Robert V. Pyle: "Spontaneous-Fission Neutrons of Californium-252 and Curium-244", in: Physical Review 1955, 98 (5), 1521–1523; doi:10.1103/PhysRev.98.1521.
- ↑ Elis Hjalmar, Hilding Slätis, Stanley G. Thompson: "Energy Spectrum of Neutrons from Spontaneous Fission of Californium-252", in: Physical Review 1955, 100 (5), 1542–1543; doi:10.1103/PhysRev.100.1542.
- ↑ E. J. Axton, BCNM Report GE/PH/01/86 (Juni 1986).
- ↑ V. V. Golushko, K. D. Zhuravlev, Yu. S. Zamyatnin, N. I. Kroshkin, V. N. Nefedov: "The average number of neutrons emitted in the spontaneous fission of Cm244, Cm246, and Cm248", in: Atomnaya Énergiya 1973, 34 (2), 135–136; doi:10.1007/BF01163947.
- ↑ P. R. Fields, M. H. Studier, H. Diamond, J. F. Mech, M. G. Inghram, G. L. Pyle, C. M. Stevens, S. Fried, W. M. Manning (Argonne National Laboratory, Lemont, Illinois); A. Ghiorso, S. G. Thompson, G. H. Higgins, G. T. Seaborg (University of California, Berkeley, California): "Transplutonium Elements in Thermonuclear Test Debris", in: Physical Review 1956, 102 (1), 180–182; doi:10.1103/PhysRev.102.180.
- ↑ J. R. Huizenga, H. Diamond: "Spontaneous-Fission Half-Lives of Cf254 and Cm250", in: Physical Review 1957, 107 (4), 1087–1090; doi:10.1103/PhysRev.107.1087.
- ↑ G. R. Burbidge, F. Hoyle (Mount Wilson and Palomar Observatories, Carnegie Institution of Washington, California Institute of Technology, Pasadena, California); E. M. Burbidge, R. F. Christy, W. A. Fowler (Kellogg Radiation Laboratory, California Institute of Technology, Pasadena, California): "Californium-254 and Supernovae", in: Physical Review 1956, 103 (5), 1145–1149; doi:10.1103/PhysRev.103.1145; PDF.
- ↑ W. Baade, G. R. Burbidge, F. Hoyle, E. M. Burbidge, R. F. Christy, W. A. Fowler: "Supernovae and Californium 254", in: Publications of the Astronomical Society of the Pacific 1956, 68, Nr. 403, 296–300; PDF.
- ↑ St. Temesváry: "Das Element Californium-254 und die Lichtkurven der Supernovae von Typ I. Ein Beitrag zur Frage der Synthese schwerer Elemente im Kosmos", in: Die Naturwissenschaften 1957, 44 (11), 321–323; doi:10.1007/BF00630928.
- ↑ Edward Anders: "Californium-254, Iron-59, and Supernovae of Type I", in: The Astrophysical Journal 1959, 129, 327–346; doi:10.1086/146624; PDF.
- ↑ S. G. Thompson, A. Ghiorso, B. G. Harvey, G. R. Choppin: "Transcurium Isotopes Produced in the Neutron Irradiation of Plutonium", in: Physical Review 1954, 93 (4), 908–908; doi:10.1103/PhysRev.93.908.
- ↑ H. Diamond, L. B. Magnusson, J. F. Mech, C. M. Stevens, A. M. Friedman, M. H. Studier, P. R. Fields, J. R. Huizenga: "Identification of Californium Isotopes 249, 250, 251, and 252 from Pile-Irradiated Plutonium", in: Physical Review 1954, 94 (4), 1083–1084; doi:10.1103/PhysRev.94.1083.
- ↑ L. B. Magnusson, M. H. Studier, P. R. Fields, C. M. Stevens, J. F. Mech, A. M. Friedman, H. Diamond, J. R. Huizenga: "Berkelium and Californium Isotopes Produced in Neutron Irradiation of Plutonium", in: Physical Review 1954, 96 (6), 1576–1582; doi:10.1103/PhysRev.96.1576.
- ↑ T. A. Eastwood, J. P. Butler, M. J. Cabell, H. G. Jackson (Atomic Energy of Canada Limited, Chalk River, Ontario, Canada); R. P. Schuman, F. M. Rourke, T. L. Collins (Knolls Atomic Power Laboratory, Schenectady, New York): "Isotopes of Berkelium and Californium Produced by Neutron Irradiation of Plutonium", in: Physical Review 1957, 107 (6), 1635–1638; doi:10.1103/PhysRev.107.1635.
- ↑ Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Band 7 a, Transurane: Teil A 1 II, S. 19–20.
- ↑ Informationen zum Element Californium bei www.speclab.com (engl.); Zugriff: 22. September 2008.
- ↑ A. Ghiorso, S. G. Thompson, K. Street, Jr., G. T. Seaborg: "Californium Isotopes from Bombardment of Uranium with Carbon Ions", in: Physical Review 1951, 81 (1), 154–154; doi:10.1103/PhysRev.81.154; Abstract; Maschinoskript (6. September 1950).
- ↑ R. J. Silva, R. L. Hahn, K. S. Toth, M. L. Mallory, C. E. Bemis, Jr., P. F. Dittner, O. L. Keller: "New Isotopes 241Cf and 240Cf", in: Physical Review C 1970, 2 (5), 1948–1951; doi:10.1103/PhysRevC.2.1948.
- ↑ R. G. Haire, R. D. Baybarz: "Crystal Structure and Melting Point of Californium Metal", in: J. Inorg. Nucl. Chem. 1974, 36 (6), 1295–1302; doi:10.1016/0022-1902(74)80067-9.
- ↑ W. H. Zachariasen: "On Californium Metal", in: J. Inorg. Nucl. Chem. 1975, 37 (6), 1441–1442; doi:10.1016/0022-1902(75)80787-1.
- ↑ a b c M. Noé, J. R. Peterson (Proc 4th intern. Transplutonium Element Symp., Baden-Baden, 1975).
- ↑ V. M. Radchenko, A. G. Seleznev, R. R. Droznik, L. S. Lebedeva, M. A. Ryabinin, V. D. Shushakov, V. Ya. Vasil'ev & V. T. Ermishev, Soviet Radiochemistry (Engl. Transl.) 1986, 28, 401; (Kristallstruktur bei WebElements).
- ↑ J. R. Peterson, U. Benedict, C. Dufour, I. Birkel, R. G. Haire: "X-ray Diffraction Study of Californium Metal to 16 GPa", in: Journal of the Less Common Metals 1983, 93 (2), 353–356; doi:10.1016/0022-5088(83)90181-9.
- ↑ J. Fuger, R. G. Haire, J. R. Peterson: "The Enthalpy of Solution of Californium Metal and the Standard Enthalpy of Formation of Cf3+(aq)", in: Journal of the Less Common Metals 1984, 98 (2), 315–321; doi:10.1016/0022-5088(84)90305-9.
- ↑ D. L. Raschella, R. G. Haire, J. R. Peterson: "First Determination of the Enthalpy of Solution of Californium Metal", in: Radiochim. Acta 1982, 30, 41–43.
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1956.
- ↑ B. F. Myasoedov, I. A. Lebedev, P. L. Khizhnyak, G. A. Timofeev, V. Ya. Frenkel: "Electrochemical Oxidation of Americium and Californium in Carbonate Solutions", in: Journal of the Less Common Metals 1986, 122, 189–193; doi:10.1016/0022-5088(86)90408-X.
- ↑ V. Ya. Frenkel, Yu. M. Kulyako, V. M. Chistyakov, I. A. Lebedev, B. F. Myasoedov, G. A. Timofeev, E. A. Erin: "Electrochemical Oxidation of Californium in Carbonate Solutions", in: Journal of Radioanalytical and Nuclear Chemistry 1986, 104 (4), 191–199; doi:10.1007/BF02165322.
- ↑ M. B. Chadwick, P. Oblozinsky, M. Herman, N. M. Greene, R. D. McKnight, D. L. Smith, P. G. Young, R. E. MacFarlane, G. M. Hale, S. C. Frankle, A. C. Kahler, T. Kawano, R. C. Little, D. G. Madland, P. Moller, R. D. Mosteller, P. R. Page, P. Talou, H. Trellue, M. C. White, W. B. Wilson, R. Arcilla, C. L. Dunford, S. F. Mughabghab, B. Pritychenko, D. Rochman, A. A. Sonzogni, C. R. Lubitz, T. H. Trumbull, J. P. Weinman, D. A. Brown, D. E. Cullen, D. P. Heinrichs, D. P. McNabb, H. Derrien, M. E. Dunn, N. M. Larson, L. C. Leal, A. D. Carlson, R. C. Block, J. B. Briggs, E. T. Cheng, H. C. Huria, M. L. Zerkle, K. S. Kozier, A. Courcelle, V. Pronyaev, S. C. van der Marck: "ENDF/B-VII.0: Next Generation Evaluated Nuclear Data Library for Nuclear Science and Technology", in: Nuclear Data Sheets 2006, 107 (12), 2931–3060; doi:10.1016/j.nds.2006.11.001.
- ↑ A. J. Koning, et al.: "The JEFF evaluated data project", Proceedings of the International Conference on Nuclear Data for Science and Technology, Nice, 2007; doi:10.1051/ndata:07476.
- ↑ a b c Institut de Radioprotection et de Sûreté Nucléaire: "Evaluation of nuclear criticality safety data and limits for actinides in transport", S. 16; PDF.
- ↑ § 2, Art. 1, AtG, keine ergänzende, Californium betreffende Rechtsverordnung vorhanden; abgerufen am 19. Januar 2009.
- ↑ K. Anderson, J. Pilcher, H. Wu, E. van der Bij, Z. Meggyesi, J. Adams: "Neutron Irradiation Tests of an S-LINK-over-G-link System" (21. November 1999); PDF.
- ↑ R. C. Martin, J. B. Knauer, P. A. Balo: "Production, Distribution, and Applications of Californium-252 Neutron Sources", 1999; PDF.
- ↑ a b c R. C. Martin, J. H. Miller: "Applications of Californium-252 Neutron Sources in Medicine, Research, and Industry", 2002(?); PDF.
- ↑ United States Patent 7118524: "Dosimetry for Californium-252 (252Cf) Neutron-emitting Brachytherapy Sources and Encapsulation, Storage, and Clinical Delivery Thereof".
- ↑ H. Vogg, H. Braun: "Neutronen-Aktivierungsanalyse mit Californium-252", Vortrag auf dem 4. Seminar "Aktivierungsanalyse", 11.–12.10.1973, Berlin; Bericht PACT 45 (1973).
- ↑ Bayerisches Staatsministerium für Umwelt, Gesundheit und Verbraucherschutz: Radioaktivität und Strahlungsmessung; 8. überarbeitete Auflage, April 2006, S. 187.
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1954.
- ↑ Yu. Ts. Oganessian, V. K. Utyonkov, Yu. V. Lobanov, F. Sh. Abdullin, A. N. Polyakov, R. N. Sagaidak, I. V. Shirokovsky, Yu. S. Tsyganov, A. A. Voinov, G. G. Gulbekian, S. L. Bogomolov, B. N. Gikal, A. N. Mezentsev (Joint Institute for Nuclear Research, 141980 Dubna, Russian Federation); K. J. Moody, J. B. Patin, D. A. Shaughnessy, M. A. Stoyer, N. J. Stoyer, P. A. Wilk, J. M. Kenneally, J. H. Landrum, J. F. Wild, R. W. Lougheed (University of California, Lawrence Livermore National Laboratory, Livermore, California 94551, USA): "Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions", in: Physical Review C 2006, 74, 044602 (9 Seiten); doi:10.1103/PhysRevC.74.044602.
- ↑ a b c R. D. Baybarz, R. G. Haire, J. A. Fahey: "On the Californium Oxide System", in: J. Inorg. Nucl. Chem. 1972, 34 (2), 557–565; doi:10.1016/0022-1902(72)80435-4.
- ↑ a b J. C. Copeland, B. B. Cunningham: "Crystallography of the Compounds of Californium. II. Crystal Structure and Lattice Parameters of Californium Oxychloride and Californium Sesquioxide", in: J. Inorg. Nucl. Chem. 1969, 31 (3), 733–740; doi:10.1016/0022-1902(69)80020-5.
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1972.
- ↑ United States Patent 3627691: "A Method of Preparing a Californium-252 Neutron Source".
- ↑ J. R. Peterson, John H. Burns: "Preparation and Crystal Structure of Californium Oxyfluoride, CfOF", in: J. Inorg. Nucl. Chem. 1968, 30 (11), 2955–2958; doi:10.1016/0022-1902(68)80155-1.
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1969.
- ↑ J. R. Peterson, R. L. Fellows, J. P. Young, R. G. Haire: "Stabilization of Californium(II) in the Solid State: Californium Dichloride, 249CfCl2", in: Radiochem. Radioanal. Lett. 1977, 31, 277–282.
- ↑ J. R. Peterson, R. D. Baybarz: "The Stabilization of Divalent Californium in the Solid State: Californium Dibromide", in: Inorg. Nucl. Chem. Lett. 1972, 8 (4), 423–431; doi:10.1016/0020-1650(72)80025-4.
- ↑ J. N. Stevenson, J. R. Peterson: "The Trigonal and Orthorhombic Crystal Structures of CfF3 and their Temperature Relationship", in: J. Inorg. Nucl. Chem. 1973, 35 (10), 3481–3486; doi:10.1016/0022-1902(73)80356-2.
- ↑ C-T. P. Chang, R. G. Haire, S. E. Nave: "Magnetic Susceptibility of Californium Fluorides", in: Physical Review B 1990, 41 (13), 9045–9048; doi:10.1103/PhysRevB.41.9045.
- ↑ J. H. Burns, J. R. Peterson, R. D. Baybarz: "Hexagonal and Orthorhombic Crystal Structures of Californium Trichloride", in: J. Inorg. Nucl. Chem. 1973, 35 (4), 1171–1177; doi:10.1016/0022-1902(73)80189-7.
- ↑ Californiumbromid (CfBr3): Der Kristall zeigt grüne Farbe.
- ↑ J. P. Young, K. L. Vander Sluis, G. K. Werner, J. R. Peterson, M. Noé: "High Temperature Spectroscopic and X-Ray Diffraction Studies of Californium Tribromide: Proof of Thermal Reduction to Californium (II)", in: J. Inorg. Nucl. Chem. 1975, 37 (12), 2497–2501; doi:10.1016/0022-1902(75)80878-5.
- ↑ J. F. Wild, E. K. Hulet, R. W. Lougheed, W. N. Hayes, J. R. Peterson, R. L. Fellows, J. P. Young: "Studies of Californium (II) and (III) Iodides", in: J. Inorg. Nucl. Chem. 1978, 40 (5), 811–817; doi:10.1016/0022-1902(78)80157-2.
- ↑ J. F. Wild, E. K. Hulet, R. W. Lougheed, W. N. Hayes: "Preparation of Californium Diiodide", Symposium Commemorating the 25th Anniversary of the Discovery of Elements 97 and 98; 20. Januar 1975; Berkeley, USA.
- ↑ a b c J. E. Macintyre, F. M. Daniel, V. M. Stirling: Dictionary of inorganic compounds, Chapman and Hall, CRC Press, 1992, ISBN 978-0-412-30120-9, S. 2826
- ↑ D. Damien, R. G. Haire, J. R. Peterson: "Californium-249 Monoarsenide and Monoantimonide", in: Inorg. Nucl. Chem. Lett. 1980, 16 (9–12), 537–541; doi:10.1016/0020-1650(80)80006-7.
- ↑ S. E. Nave, J. R. Moore, R. G. Haire, J. R. Peterson, D. A. Damien, Paul G. Huray: "Magnetic Susceptibility of CfN, CfAs and CfSb", in: Journal of the Less Common Metals 1986, 121, 319–324; doi:10.1016/0022-5088(86)90548-5.
- ↑ Christoph Elschenbroich: Organometallchemie, 6. Auflage, Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 583–584.
- ↑ Peter G. Laubereau, John H. Burns: "Microchemical Preparation of Tricyclopentadienyl Compounds of Berkelium, Californium, and some Lanthanide Elements", in: Inorg. Chem. 1970, 9 (5), 1091–1095; doi:10.1021/ic50087a018.
Literatur
- Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Band 7 a, Transurane: Teil A 1 I, S. 40–43; Teil A 1 II, S. 19–20; Teil A 2, S. 222–233; Teil B 1, S. 76–82.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Auflage, VCH, Weinheim 1988, ISBN 3-527-26169-9.
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- James E. Huheey: Anorganische Chemie, 1. Auflage, de Gruyter, Berlin 1988, ISBN 3-11-008163-6.
- Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer-Verlag, Dordrecht 2006, ISBN 1-4020-3555-1.
Weblinks
- C&EN: It's Elemental: The Periodic Table – Californium (engl.)
- Bilder von CfBr3, CfOCl und Cf-Metall (engl.)
- Elementymology & Elements Multidict by Peter van der Krogt (Californium) (engl.)
- DER SPIEGEL 17/1950 vom 27. April 1950, Seite 41; PDF.
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.




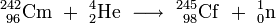

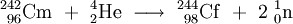
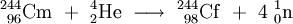
![\mathrm{^{251}_{\ 98}Cf\ \xrightarrow[900 \ a]{\alpha} \ ^{247}_{\ 96}Cm\ \xrightarrow[15,6\ x\ 10^6 \ a]{\alpha} \ ^{243}_{\ 94}Pu\ \xrightarrow [4,956 \ h]{\beta^-} \ ^{243}_{\ 95}Am}](/pictures/dewiki/100/dcb978e64a5b90c376bb8518312a73cb.png)
![\mathrm{^{239}_{\ 94}Pu\ \xrightarrow {4(n,\gamma)} \ ^{243}_{\ 94}Pu\ \xrightarrow [4,956 \ h]{\beta^-} \ ^{243}_{\ 95}Am\ \xrightarrow {(n,\gamma)} \ ^{244}_{\ 95}Am\ \xrightarrow [10,1 \ h]{\beta^-} \ ^{244}_{\ 96}Cm} \quad; \quad \mathrm{^{244}_{\ 96}Cm\ \xrightarrow {5(n,\gamma)} \ ^{249}_{\ 96}Cm}](/pictures/dewiki/55/7e5c9a1f5b7d8986153027630db39fbd.png)
![\mathrm{^{249}_{\ 96}Cm\ \xrightarrow [64,15 \ min]{\beta^-} \ ^{249}_{\ 97}Bk\ \xrightarrow [330 \ d]{\beta^-} \ ^{249}_{\ 98}Cf}](/pictures/dewiki/55/74858dc4d52cdf86fe8f9800ec544f31.png)
![\mathrm{^{249}_{\ 97}Bk\ \xrightarrow {(n,\gamma)} \ ^{250}_{\ 97}Bk\ \xrightarrow [3,212 \ h]{\beta^-} \ ^{250}_{\ 98}Cf}](/pictures/dewiki/49/17318f4cd18734815ae5aafff6151a77.png)
![\mathrm{^{238}_{\ 92}U\ \xrightarrow [-\ 6\ n]{\mathrm{+\ ^{12}_{\ 6}C}} \ ^{244}_{\ 98}Cf \quad; \quad ^{238}_{\ 92}U\ \xrightarrow [-\ 4\ n]{\mathrm{+\ ^{12}_{\ 6}C}} \ ^{246}_{\ 98}Cf}](/pictures/dewiki/98/b4d8c20b6047e6332d606821b7887e3c.png)
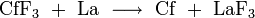

![\mathrm{^{249}_{\ 98}Cf\ \xrightarrow [-\ 2\ n,\ -\ \alpha]{\mathrm{+\ ^{12}_{\ 6}C}} \ ^{255}_{102}No}](/pictures/dewiki/97/a5da1724247ed79884ec079b712afae8.png)