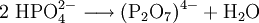- Kaliumdiphosphat
-
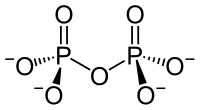 Diphosphat-Anion
Diphosphat-AnionDiphosphate (auch Pyrophosphate (PPa; engl.: PPi)) sind Salze und Ester der Diphosphorsäure H4P2O7. Diphosphate sind Kondensate von zwei Phosphaten. Sie sind über eine P–O–P-Säureanhydrid-Bindung miteinander verknüpft (Konstitutionsformel ((O3P)–O–(PO3)4−). Die Ester dieser Verbindungen verfügen zusätzlich über eine C–O–P-Bindung und haben die allgemeine Konstitutionsformel R–O–((PO2)–O–(PO3))3− (R: organischer Rest).
Inhaltsverzeichnis
Beispiele
Salze der Diphosphorsäure Name Formel andere Bezeichnung Dinatriumdihydrogendiphosphat Na2H2P2O7 E 450a Trinatriumhydrogendiphoshat Na3HP2O7 E 450b Tetranatriumdiphosphat Na4P2O7 E 450c Weitere Beispiele siehe Kategorie:Phosphat Ester der Diphosphorsäure Name Formel Dimethylallylpyrophosphat 
Adenosindiphosphat 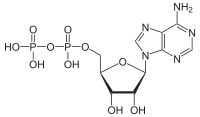
Weitere Beispiele siehe Kategorie:Phosphorsäureester Synthese
Glüht man sekundäre Phosphate, wird unter Wasserabspaltung Diphosphat gebildet:
Biochemische Bedeutung
Diphosphathaltige Verbindungen spielen bei Energieübertragungsprozessen in lebenden Zellen eine wichtige Rolle (vgl. etwa Adenosindiphosphat, das beim Verbrauch von Adenosintriphosphat anfällt). Die Abspaltung des Diphosphats setzt Energie frei, da das entstehende freie Diphosphat durch Mesomerie und Hydratation einerseits stabilisiert wird. Andererseits kommt auch ein entropischer Effekt zum Tragen, da sich die Entropie des Systems erhöht hat. Diese Energie wird häufig genutzt, um eine an diesem Vorgang gekoppelte, indes endotherme Reaktion zu ermöglichen. Häufig werden Diphosphate durch Pyrophosphatasen in zwei Phosphate gespalten, um die jeweilige Reaktion irreversibel zu gestalten. Es wird auch diskutiert, ob neben ATP auch Diphosphate als alternative Energiedonatoren in Bakterien und Pflanzen genutzt werden können.[1][2]
Lebensmittelchemie
Diphosphate sind als Lebensmittelzusatzstoff unter der Nummer E 450 zugelassen und kommen in der Lebensmittelchemie unter anderem als Emulgatoren vor, haben jedoch eine Reihe weiterer Eigenschaften und können etwa auch als Konservierungs-, Antioxidations-, Trenn- und Backtriebmittel fungieren. Diese künstlich hergestellte Emulgatorklasse bindet Wasser, verhindert Verklumpen pulverförmiger Lebensmittel und führt in Verbindung mit Calcium zu einer cremigen Konsistenz. Da Phosphor im Verdacht steht Hyperaktivität, allergische Reaktionen und Osteoporose auszulösen, sollte bei der Einnahme von Phosphaten stets auf die richtige Dosierung geachtet werden.
Literatur
- ↑ Serrano A. et al.: H+-PPases: yesterday, today and tomorrow. IUBMB Life. 2007;59(2):76–83, PMID 17454298
- ↑ Baltscheffsky M.: Inorganic pyrophosphate as an energy donor in photosynthetic and respiratory electron transport phosphorylation systems. Biochem Biophys Res Commun. 1967;28(2):270–6, PMID 4291991
Wikimedia Foundation.