- Keratin
-
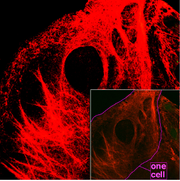 Keratinfilamente in einer Tumorzelle, fluoreszenzmikroskopisch dargestellt
Keratinfilamente in einer Tumorzelle, fluoreszenzmikroskopisch dargestelltKeratin (von griech. kéras, Genitiv kératos = Horn) oder Hornsubstanz ist ein Sammelbegriff für verschiedene wasserunlösliche Faserproteine, die von menschlichen oder tierischen Organismen gebildet werden. Aufgrund ihrer molekularen Konformation (α-Helix oder β-Faltblatt) unterscheidet man α- und β-Keratine.
Keratine sind der Hauptbestandteil von Säugetierhaar, Reptilienschuppen, Federn, Nägeln und Klauen, Hörnern und der Barten der Wale. Die Festigkeit dieser Keratine wird durch Faserbildung verstärkt: die einzelnen Aminosäureketten bilden eine rechtsgängige Alpha-Helix. Zwei dieser Helices bilden eine linksgängige Superhelix und zwei dieser Superhelices eine Protofibrille. (-> nur bei alpha-Keratin) Mehrere Protofibrillen vereinigen sich zu einer Mikrofibrille; diese vereinigen sich ihrerseits zu Bündeln und bilden Makrofibrillen aus. Die Fasern sind umso steifer, je stärker ihre Komponenten durch Disulfidbrücken der Aminosäure L-Cystin quervernetzt sind. So enthält das Keratin in Hörnern und Klauen mehr Disulfidbrücken als das in Wolle und Haaren.
Vor der Verhornung sowie allgemein in Epithelien der Wirbeltiere und anderer Tiergruppen liegen α-Keratine (oder Cytokeratine) in Form von lose organisierten Keratinfilamenten vor. Diese gehören zu den Intermediärfilamenten, welche zusammen mit den Mikrotubuli und Mikrofilamenten das Zytoskelett der eukaryotischen Zellen bilden. Derzeit sind 20 verschiedene Cytokeratin-Proteine bekannt (siehe Tabelle), deren Molekülmasse zwischen 40 und 68 kDa liegt. CK1–CK8 werden zur neutral-basischen Typ-A Subfamilie gezählt, während CK9–CK20 die saure Typ-B Subfamilie darstellen. Diese bilden paarweise in den Intermediärfilamenten einen Heterodimer-Komplex bestehend aus einem Typ-A und einem Typ-B Cytokeratin. Die Verteilungsmuster dieser Komplexe unterscheidet sich in den einzelnen epithelialen Zellen erheblich, sodass mit einem Antikörpernachweis gegen die Subtypen CK1–CK20 die Herkunft dieser Zellen eingegrenzt werden kann. Dies macht man sich in der Medizin in der pathologischen Diagnostik zu nutze, um die Herkunft von Tumormetastasen bestimmen zu können.
A (neutral-basisch) B (sauer) Vorkommen CK 1, 2 CK 9, 10 mehrschichtig-verhornendes Epithel (Epidermis) CK 3 CK 12 Hornhaut (Cornea) CK 4 CK 13 mehrschichtig-unverhorntes Epithel CK 5 CK 14, CK15 Basalzellen komplexer Epithelien sowie Myoepithelzellen CK 6 CK 16, CK17 mehrschichtig-unverhorntes Plattenepithel, Proliferation CK 7 CK 19 einschichtiges Epithel, luminale Drüsenzellen CK 8 CK 18, CK20 einschichtiges Epithel, luminale Drüsenzellen Ein Beispiel für ein β-Keratin ist das Fibroin oder Seidenprotein der Spinnennetze und der Seide. Im Unterschied zu den α- oder Cytokeratinen ist es kein intrazelluläres Strukturprotein, sondern ein Ausscheidungsprodukt der Spinndrüsen. Wegen seiner Faltblattstruktur ist es sehr viel weniger dehnbar als die helikal gebauten α-Keratine.
Technische Verwendung
Aus keratinhaltigen Naturstoffen werden L-Cystin, L-Tyrosin und andere proteinogene Aminosäuren im technischen Maßstab hergestellt. Dazu werden die Naturstoffe zuerst mit Salzsäure hydrolysiert. Das Hydrolysat wird mit Ammoniak neutralisiert. Die einzelnen L-Aminosäuren werden dann aufgrund unterschiedlicher Löslichkeiten abgetrennt oder nach dem Prinzip der Ionenaustausch-Chromatographie isoliert.
Wikimedia Foundation.
