- Kohlenstoffsäure
-
Strukturformel 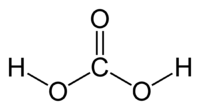
Allgemeines Name Kohlensäure Andere Namen - Kohlenstoffsäure
- Dihydrogencarbonat
- Hydroxyameisensäure
- Hydroxymethansäure
Summenformel H2CO3 CAS-Nummer 463-79-6 Eigenschaften Molare Masse 62,03 g·mol–1 Aggregatzustand existiert nur gelöst
pKs-Wert - 3,30 [1]
- 10,25
Löslichkeit gut in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze WGK nicht wassergefährdender Stoff [2] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kohlensäure (H2CO3) ist eine Säure und das Reaktionsprodukt ihres Säureanhydrids Kohlenstoffdioxid (CO2) mit Wasser. Die Salze der zweiprotonigen Säure heißen Carbonate bzw. Hydrogencarbonate, auch ihre Ester werden Carbonate genannt. Technische Bedeutung haben die Polyester, die als Polycarbonate bezeichnet werden.
Das Gas CO2 ist im Vergleich zu O2 und N2 relativ gut löslich in Wasser und reagiert zu einem geringen Anteil (etwa 0,2 %, je nach Temperatur) zu Kohlensäure:
Das Gas CO2 wird umgangssprachlich oft ungenau als Kohlensäure bezeichnet. Tatsächlich wird in der Wasserchemie gelöstes CO2 mit der eigentlichen Säure H2CO3 üblicherweise als „freie Kohlensäure“ zusammengefasst. Kohlensäure spielt eine wichtige Rolle im Säure-Basen-Haushalt sowohl des Wassers als auch des Blutes und der Körperflüssigkeiten.
Inhaltsverzeichnis
Dissoziationsgleichgewicht
Gelöstes Kohlendioxid steht in wässriger Lösung im Gleichgewicht mit Kohlensäure:
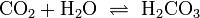 (1)
(1)
Da Kohlensäure formal eine Verletzung der Erlenmeyer-Regel darstellt, liegt das Gleichgewicht sehr weit auf der Seite des Anhydrids; der Anteil des Säuremoleküls liegt in wässriger Lösung bei nur rund 0,2 %. Dieser Anteil ist mäßig von der Temperatur abhängig. In Organismen wird die Reaktion durch das Enzym Carboanhydrase beschleunigt. Die Kohlensäure ist eine zweiprotonige Säure. Sie gibt daher ihre Protonen in zwei Dissoziationsstufen an Wasser oder andere Basen ab:
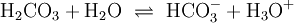 (2)
(2)
Der pKs-Wert der ersten Säurekonstante liegt (mit temperaturabhängigen Abweichungen) eigentlich bei ca. 3,88, vergleichbar mit Essigsäure und Zitronensäure. Da aber der Anteil der Kohlensäure gemäß Gleichung 1) schlecht zu bestimmen ist, werden die Reaktionen (1) und (2) zu (3) zusammengefasst:
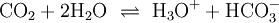 (3)
(3)
und ergeben den (fast immer genannten) Wert von ca. 6,5 für den pKs-Wert. Reaktionsprodukt ist das Hydrogencarbonat-Ion HCO3−.
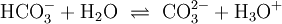 (4)
(4)
Der pKs-Wert für die zweite Säurekonstante liegt um 10,5. Reaktionsprodukt ist das Carbonat-Ion CO32−.
Als Trivialnamen für die Summe aus gelöstem Kohlendioxid und Kohlensäure ist „freie Kohlensäure“ gebräuchlich. Sie steht der Summe von Carbonat und Hydrogencarbonat als der „gebundenen Kohlensäure“ gegenüber.
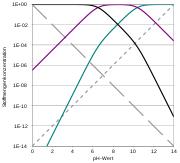 Hägg-Diagramm von Kohlensäure (logarithmische Skala) – H2CO3: schwarz; HCO3−: violett; CO32−: blau; H+: gestrichelt; OH−: gepunktet
Hägg-Diagramm von Kohlensäure (logarithmische Skala) – H2CO3: schwarz; HCO3−: violett; CO32−: blau; H+: gestrichelt; OH−: gepunktetDie Konzentrationen der drei (eigentlich vier) Kohlensäure-Spezies, also der „freien Kohlensäure“, des Hydrogencarbonats und des Carbonats sowie der Oxoniumionen stehen miteinander durch das Massenwirkungsgesetz in einem berechenbarem Zusammenhang. Die Konzentration der Hydroniumionen wird durch den pH-Wert ausgedrückt. Bei einem gegebenen pH-Wert ist somit das Mengenverhältnis der Spezies festgelegt:
Bei pH 4 liegen mehr als 99 % als „freie Kohlensäure“ vor. Bei einem pH-Wert von 6,5, der also gleich ist dem pKs der ersten Säurekonstante, liegen gleich viel „freie Kohlensäure“ und Hydrogencarbonat vor; der Anteil des Carbonats ist noch weit unter 1 %. Etwa bei pH 8,3 liegt der maximale Anteil an Hydrogencarbonat mit ca. 98 % vor; je knapp 1 % sind „freie Kohlensäure“ bzw. Carbonat. Bei einem pH gleich dem pKs der zweiten Säurekonstante von 10,5 liegen gleiche Mengen Hydrogencarbonat und Carbonat sowie ein verschwindender Anteil an „freier Kohlensäure“ vor. Bei pH 12,5 hat das Carbonat einen Anteil um 99 %, Hydrogencarbonat noch knapp 1 %, „freie Kohlensäure“ noch Spuren.
Kohlensäure als Reinsubstanz
Im Labor ist es gelungen, Kohlensäure (im engeren Sinn) als Reinsubstanz zu gewinnen. Das ist jedoch – praktisch betrachtet – eher eine wissenschaftliche Kuriosität. Bei tiefen Temperaturen und unter absoluter Abwesenheit von Wasser oder Metallionen (beide katalysieren stark die Zersetzungsreaktion zu Kohlenstoffdioxid und Wasser) kann die Kohlensäure H2CO3 als wasserklare, farblose Flüssigkeit dargestellt werden.[3][4]
„Aggressive Kohlensäure“ und Verwandte
Eine weitere Gruppe von Trivialnamen, der nicht chemisch unterschiedliche Spezies, sondern Mengenanteile bezeichnen, stammt aus dem Bereich der Wasserchemie für kalkhaltige Wässer. Es sei darauf hingewiesen, dass diese folgenden Begriffe jeweils Mengenanteile der sogenannten „freien Kohlensäure“ betreffen, bei denen zwischen Kohlendioxid und der Kohlensäure im engeren Sinn nicht unterschieden wird.
Entsprechend dem Kalk-Kohlensäure-Gleichgewicht sind die Konzentrationen von Calcium und Kohlensäure voneinander abhängig. Man unterscheidet die Menge der „zugehörigen“ Kohlensäure von der Menge der „überschüssigen“ und der „(kalk-)aggressiven Kohlensäure“. „Zugehörige“ Säure hält im Mengengleichgewicht der Kohlensäurespezies den pH-Wert gerade so niedrig, dass die hiervon abhängige Konzentration des Carbonates multipliziert mit der des Calciums gerade noch nicht das Löslichkeitsprodukt des Calciumcarbonats überschreitet. Darüber hinaus vorhandene „freie Kohlensäure“ gilt als „überschüssig“. Davon wiederum ein Teil könnte weiteren Kalk in Lösung bringen, ist also „(kalk-)aggressiv“.
Mit steigendem Werten für die Carbonathärte steigt der Anteil der zugehörigen freien Kohlensäure überproportional an. Beispielsweise beträgt dieser Wert bei 5,1 °dH 1,83 mg/l CO2 und bei 10,2 °dH 11,67 mg/l CO2. Dies führt bei der Mischung von Wässern zu einem Mischwasserproblem. Die Mischung von Wässern mit unterschiedlicher Carbonathärte ergibt Mischwässer mit aggressiver Kohlensäure, selbst wenn die Ausgangswässer im Kalk–Kohlensäure–Gleichgewicht waren.
Die mathematischen Zusammenhänge sind in der Tillmansschen Gleichung zusammengefasst, mit der die zugehörige „freie Kohlensäure“ für jeden Gehalt an Calcium berechnet werden kann. Nachfolgend die Kurzfassung dieser Gleichung:
Die Elemente der Gleichung bedeuten: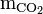 = Konzentration der zu berechnenden zugehörigen freien Kohlensäure (CO2) in mol/kg
= Konzentration der zu berechnenden zugehörigen freien Kohlensäure (CO2) in mol/kg
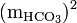 = Quadrat der Konzentration der Hydrogencarbonate (HCO3) in mol/kg
= Quadrat der Konzentration der Hydrogencarbonate (HCO3) in mol/kg
- mCa = Konzentration des Calciums in mol/kg
Weitere Einzelheiten hierzu unter Tillmanssche Gleichung.
Für die Aufbereitung und Entkarbonisierung von Wässern ist die genaue Kenntnis dieses Gleichgewichtes und seiner Einstellgeschwindigkeit von großer Bedeutung. So wird bei der Trinkwasseraufbereitung das Rohwasser über halbgebranntes Dolomit (Calciummagnesiumcarbonat, CaMg(CO3)2) geleitet, damit es keine überschüssige „freie Kohlensäure“ enthält, da Eisen oder andere Metalle mit dieser reagieren und so beispielsweise Rohrleitungen aus Stahl korrodieren würden. Auch diese Reaktionen sind konzentrationsabhängig im Gleichgewicht mit entsprechenden Carbonaten. Deshalb spricht man dann z. B. von „Eisen-aggressiver Kohlensäure“. Dolomit wird verwendet, weil in Anwesenheit von Magnesiumionen die Einstellgeschwindigkeit des Tillmans'schen Gleichgewichtes erheblich beschleunigt wird, was mit reinem Calciumcarbonat viel zu lange dauern würde.Bei manchen Anwendergruppen, z. B. in der Fischerei, werden die hier genannten Mengenbegriffe oft so missverstanden, als ob z. B. die „aggressive Kohlensäure“ besonders schädlich wäre, etwa für die Fische. Da aber Fische nicht aus Kalk bestehen, richtet sich die aggressive Kohlensäure nicht in anderer Weise gegen sie als der Rest der Kohlensäure. Für die Atmung der Fische ist vielmehr die gesamte gelöste CO2-Konzentration ausschlaggebend, für eine allfällige sauere Verätzung ausschließlich der pH-Wert des Wassers. Die „zugehörige Kohlensäure“ wird dort so missverstanden, als ob sie in besonderer Weise an das Hydrogencarbonat gebunden und deshalb nicht durch Wasserbelüftung auszutreiben oder durch Photosynthese von Algen zu verbrauchen wäre. Tatsächlich steht beiden Vorgängen die gesamte „freie Kohlensäure“ zur Verfügung, so dass es zu einer Steigerung des pH-Wertes, dadurch zu einer Verschiebung des Mengengleichgewichts hin zu mehr Carbonat und dadurch schließlich zu einer Überschreitung des Löslichkeitsproduktes des Kalkes, also zu einer Kalkfällung kommt.
Derivate der Kohlensäure
Darüber hinaus sind organische Derivate der Kohlensäure bekannt, so verschiedene Kohlensäureester. Sie sind leicht zugänglich durch die Reaktion von Phosgen mit Alkoholen. Von technischer Bedeutung sind vor allem die Amide der Kohlensäure. Ihre Stammverbindung ist der Harnstoff; als Beispiel seien die Urethane (von Urea, Harnstoff) genannt. Es sind substituierte Ester des Monoamids der Kohlensäure, der Carbaminsäure; diese sind die Stammverbindungen überaus wichtiger Kunststoffe, der Polyurethane.
Verwendung
Kohlensäure wird für unzählige Produktionsprozesse weltweit eingesetzt, wobei sie dem Endverbraucher wohl am ehesten aus Erfrischungsgetränken bekannt sein dürfte. Johann Jacob Schweppe entwickelte im späten 18. Jahrhundert ein Verfahren, mittels dessen sich Wasser mit Kohlensäure versetzen lässt. Im 19. Jahrhundert begann man Kohlensäure Mineralwasser beizumischen, um dieses haltbar zu machen. Des Weiteren ist die Kohlensäure ein wichtiger Bestandteil der sterilen Verpackungstechnik.
Literatur
- Ulrich Kölle: Rund um Kohlensäure. In: Chemkon.10, Nr. 2, 2003, ISSN 0944-5846, S. 66–68.
- Th. Loerting, Chr. Tautermann, R. T. Kroemer: On the Surprising Kinetic Stability of Carbonic Acid. In: Angew. Chem. Int. Ed. 39, Nr. 5, 2000, ISSN 1433-7851, S. 891–894.
deutsch: Th. Loerting, Chr. Tautermann, R. T. Kroemer: Zur überraschenden kinetischen Stabilität von Kohlensäure. In: Angew. Chem. 112, 2000, ISSN 0044-8249 S. 919–922 (doi:10.1002/(SICI)1521-3757(20000303)112:5%3C919::AID-ANGE919%3E3.0.CO%3B2-Y). - Kurt Bauer : Zur Bedeutung der Kohlensäure in Karpfenteichen]. In: Österreichs Fischerei 44, 1991, S. 49–64 (HTML).
- Julius Pia: Kohlensäure und Kalk − Einführung in das Verständnis ihres Verhaltens in den Binnengewässern. In: Die Binnengewässer. Bd. XIII, Schweizerbart, Stuttgart 1933, ISBN 978-3-510-40713-2.
- H. E. Hömig: Physikochemische Grundlagen der Speisewasserchemie. 2. Auflage, Vulkan-Verlag, Essen 1963, Kap. 2.25–2.30.
Quellen
- ↑ Quantitative und Instrumentelle Analytik; Eberhard Ehlers; Deutscher Apotheker Verlag Stuttgart
- ↑ a b Eintrag zu CAS-Nr. 463-79-6 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 14. August 2007 (JavaScript erforderlich)
- ↑ Bericht: uni-protokolle.de
- ↑ Thomas Loerting, Christofer Tautermann, Romano T. Kroemer, Ingrid Kohl, Andreas Hallbrucker, Erwin Mayer, Klaus R. Liedl: in Angew. Chem. 2000, 112, 919-922. Zur überraschenden kinetischen Stabilität von Kohlensäure (H2CO3)
Weblinks
Wikimedia Foundation.

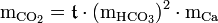
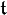 =
=