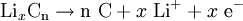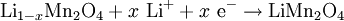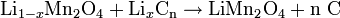- Li-Ionen
-
 Lithium-Ionen-Akkumulator von VARTA
Lithium-Ionen-Akkumulator von VARTAEin Lithium-Ionen-Akkumulator (auch Lithium-Ionen-Akku, Li-Ionen-Akku, Li-Ionen-Sekundärbatterie, Lithium-Akkumulator oder kurz Li-Ion) ist ein Akkumulator auf der Basis von Lithium. Der Li-Ionen-Akku zeichnet sich durch hohe Energiedichte aus. Er ist thermisch stabil, liefert über den Entladezeitraum eine konstante Spannung und unterliegt keinem Memory-Effekt. [1] Der erste kommerziell erhältliche Li-Ionen-Akku wurde von Sony im Jahr 1991 auf den Markt gebracht und in der 8-mm-Videokamera CCD TR 1 eingesetzt [2].
Weiterentwicklungen des Li-Ionen-Akkus sind der Lithium-Polymer-Akku, der Lithium-Titanat-Akku, der SCiB, der Lithium-Mangan-Akkumulator und der Lithium-Eisen-Phosphat-Akkumulator.
Inhaltsverzeichnis
Prinzip
Ein Lithium-Ionen-Akku erzeugt die Quellenspannung durch die Verschiebung von Lithium-Ionen.
Beim Ladevorgang wandern positiv geladene Lithium-Ionen durch einen Elektrolyt hindurch von der positiven Elektrode (Anode) zwischen die Graphitebenen (nC) der negativen Elektrode (Kathode), während der Ladestrom die Elektronen über den äußeren Stromkreis liefert; die Ionen bilden mit dem Kohlenstoff eine Interkalationsverbindung (LixnC). Beim Entladen wandern die Lithiumionen zurück in das Metalloxid und die Elektronen können über den äußeren Stromkreis zur positiven Elektrode (nunmehr die Kathode) fließen.
Wesentlich für das Funktionieren der Interkalation ist die Ausbildung einer schützenden Deckschicht auf der negativen Elektrode, die für die kleinen Li+-Ionen durchlässig, für Lösungsmittelmoleküle jedoch undurchlässig ist. Ist die Deckschicht ungenügend ausgebildet, kommt es zur Interkalation von Li+-Ionen mitsamt den Lösungsmittelmolekülen, wodurch die Graphitelektrode irreversibel zerstört wird.
Eine negative Elektrode aus Lithium-Metall wäre elektrochemisch optimal, ist für einen Akku aber ungeeignet: Da sich die Elektrode beim Entladevorgang genauso wie bei einer Lithium-Batterie auflöst, besteht beim Ladevorgang keine Möglichkeit mehr, ihre Geometrie zu rekonstruieren.
Aufbau
Das aktive Material der negativen Elektrode eines gängigen (2005) Li-Ionen-Akkus besteht aus Graphit. Die positive Elektrode enthält meist Lithium-Metalloxide in Schichtstruktur wie LiCoO2 (Lithiumcobaltdioxid), LiNiO2 oder dem Spinell LiMn2O4.
Der Lithium-Ionen-Akkumulator muss komplett wasserfrei sein (Gehalt an H2O <20 ppm), da das Wasser mit dem Leitsalz LiPF6 zu HF (Flusssäure) reagiert. Meist wählt man eine Mischung von wasserfreien, aprotischen Lösungsmitteln (Ethylencarbonat, Propylencarbonat) mit niedrigviskosen Alkylcarbonaten/Ethern (Dimethylcarbonat, Diethylcarbonat oder 1,2-Dimethoxyethan) und Lithiumsalzen als Elektrolyten.
Mit folgenden Materialien wird experimentiert (die älteren Materialien zuerst):
- Negative Elektrode
- Graphit (Interkalation von Lithium)
- Nanokristallines, amorphes Silizium (Interkalation von Lithium)
- Li4Ti5O12 (siehe Lithium-Titanat-Akku)
- Elektrolyt
- Salze, wie LiPF6 (Lithiumhexafluorophosphat) oder LiBF4 (selten) in wasserfreien aprotischen Lösungsmitteln (z. B. Ethylencarbonat, Diethylencarbonat etc.)
- Polymer aus Polyvinylidenfluorid (PVDF) oder Polyvinylidenfluorid-Hexafluorpropen (PVDF-HFP)
- Positive Elektrode
- LiCoO2
- LiNiO2
- LiNi1−xCoxO2
- LiNi0,85Co0,1Al0,05O2
- LiNi0,33Co0,33Mn0,33O2
- LiMn2O4 Spinell
- LiFePO4 (siehe Lithium-Eisen-Phosphat-Akkumulator)
Reaktionsgleichungen
Negative Elektrode (Entladung):
Positive Elektrode (Entladung):
Redox-Gleichung:
Metallisches Lithium kommt in keiner Reaktion vor, es werden lediglich Li+-Ionen zwischen den Elektroden transferiert. Dadurch sind Li-Ionen-Akkus sicherer als Li-Batterien. Zwar wäre metallisches Lithium aufgrund der wesentlich größeren Energiedichte günstiger, jedoch scheidet sich Lithium aufgrund der Deckschichten auf der Elektrodenoberfläche nicht als kompaktes Metall, sondern fein verteilt ab, wodurch sich ein hochreaktiver Li-Schwamm bildet. Durch Dendritenwachstum durch den Separator kann es zum Kurzschluss und dadurch zum Entzünden des Lithiums kommen.
Eigenschaften
Li-Ionen-Akkus kennen keinen Memory-Effekt [1] und haben eine geringe Selbstentladung. Der Wirkungsgrad, also das Verhältnis zwischen Entlademenge zu Lademenge, liegt beim Lithium-Ionen-Akku aufgrund der hohen Beweglichkeit der Lithiumionen und des dadurch bedingten niedrigen Innenwiderstands bei ca. 96 %. Der Wirkungsgrad ist temperaturabhängig und nimmt mit niedriger Temperatur stark ab.
- Lebensdauer
- Die nutzbare Lebensdauer beträgt mehrere Jahre; allerdings ist dies stark von der Nutzung und den Lagerungsbedingungen abhängig. Meist wird eine Lebensdauer von ca. 500 Ladezyklen angegeben [3] Die Alterung eines Li-Ionen-Akkus hängt mehr von seinem Produktionsdatum als von der Anzahl der Lade-/Entladezyklen ab. Ein älterer Akku wird daher – im Gegensatz zu anderen Akkutypen – allein aufgrund seines Alters eine geringere Kapazität als ein neuerer Akku aufweisen. Hohe Lager-/Betriebstemperaturen, hohe Lade-/Entladeströme und häufige Tiefentladungen verkürzen die Lebensdauer. [4]
Material Spannung LiCoO2 3,6 V LiMnO2 3,7…3,8 V LiFePO4 3,3 V Li2FePO4F 3,6 V - Spannung
- Ein konventioneller Li-Ionen-Akku liefert eine Nennspannung von 3,6 Volt, die damit rund dreimal so hoch wie die eines Nickel-Metallhydrid-Akkumulators (NiMH-Akku) ist. Die Ladeschlusspannung liegt bei 4,2 Volt. Die Entladeschlusspannung beträgt 2,5 Volt, eine Tiefentladung auf unter 2,4 Volt führt zu irreversibler Schädigung und Kapazitätsverlust. Die Zellenspannung hängt jedoch vom verwendeten Kathodenmaterial ab und ist daher von Akkutyp zu Akkutyp leicht verschieden. [5]
Material Gravimetrische
KapazitätLiCoO2 110…190 mAh/g LiMnO2 110…120 mAh/g Li2FePO4F 95…140 mAh/g - Energie- und Leistungsdichte
- Die spezifische Leistungsdichte liegt zwischen 300–1500 W/kg @ 20 Sekunden [3]. Die Energiedichte ist etwa doppelt so hoch wie beispielsweise die des Nickel-Cadmium-Akkumulators und liegt bei 95−190 Wh/kg. Achtet man auf eine Entladespannung von minimal 2,5 V, um die Lebensdauer zu erhöhen, reduziert sich die Energiedichte auf ca. 60–70 Wh/kg. Heutige Li-Ionen Akkus für Kraftfahrzeuge erreichen eine Energiedichte von über 120 Wh/kg (zum Vergleich: Bleiakkumulatoren erreichen ca. 30 Wh/kg). Diese hängt auch wesentlich vom verwendeten Kathodenmaterial ab[5]:
- Kapazität
- Die Kapazität eines Lithium-Ionen-Akkus verringert sich selbst ohne Benutzung mit der Zeit, hauptsächlich durch parasitäre Reaktion des Lithiums mit den Elektrolyten. Die Zersetzungsgeschwindigkeit steigt mit der Zellspannung und der Temperatur. Im Gegensatz zum NiMH-Akku kann man einen Kapazitätsverlust beim Lithium-Ionen-Akku nicht durch zyklisches Laden/Entladen wieder rückgängig machen, er ist bei diesem Akkutyp endgültig.
Hinweise zum Umgang mit Li-Ionen-Akkus
Viele der im Folgenden für den Umgang mit klassischen Li-Ionen-Akkus zu beachtenden Anwendungshinweise gelten für dessen aktuelle Weiterentwicklungen nur mehr eingeschränkt oder gar nicht.
- Ladung
- Die Ladespannung beträgt typischerweise 4,2 V. Da Li-Ion-Akkus keinen Memory-Effekt kennen und auch nicht formiert werden müssen, werden sie immer auf dieselbe Art geladen: Zuerst wird mit konstantem Strom geladen, der idealerweise zwischen 0,6 und 1 C liegen sollte. Die Abkürzung C steht hier für den auf die Kapazität bezogenen relativen Ladestrom und ist nicht mit der Einheit Coulomb zu verwechseln; ein Ladestrom von 1 C bedeutet, dass ein Akku mit einer Kapazität von 2 Ah mit 2 A geladen wird. Erreicht der Akku eine Zellenspannung von 4,2 V, wird diese Spannung gehalten, bis der Ladestrom fast auf Null zurückgefallen ist. Die Ladung wird mit Erreichen von 3 % des Anfangsstroms beendet oder wenn der Ladestrom nicht mehr weiter absinkt. [5]. Die Ladeschlussspannung von produktabhängig 4,1 V bis 4,2 V muss mit weniger als 50 mV Toleranz eingehalten werden. Zwar gibt es Schnellladeelektroniken, die mit bis zu 2 C laden, jedoch wird die Verkürzung der Ladezeit durch Kapazitäts- und Lebensdauerverlust des Akkus erkauft. Liegt die Zellenspannung unterhalb der Tiefentladeschwelle, lädt die Ladeelektronik bis zum Erreichen der Mindestspannung zunächst nur mit geringer Stromstärke [1]. Neue Entwicklungen wie z. B. die SCiB erlauben auch ohne Einbußen an Lebensdauer erheblich höhere Ladeströme von über 10 C.
- Entladung
- Die Spannung des Li-Ion-Akkus sinkt während der Entladung kaum ab; erst kurz vor der vollständigen Entladung geht die Zellenspannung stark zurück [6]. Entladeschlussspannung ist 2,5 V; diese darf nicht unterschritten werden. Bei Entladung mit einem Fünftel der Nennkapazität (0,2 C) können 500 Lade-/Entladezyklen durchgeführt werden bis der Akku auf 80 % seiner Ursprungskapazität zurückgefallen ist. Bei Entladung mit Nennkapazität (1 C) altert der Akku doppelt so schnell: Nach schon 250 Zyklen hat er nur mehr 80 % seiner Anfangskapazität. Idealerweise sollte ein Li-Ion Akku mit maximal 20 % seiner Nennkapazität belastet werden, ein Akku mit einer Kapazität von 5000 mAh also mit maximal 1000 mA. [7]
- Idealer Ladungszustand
- Es ist empfehlenswert, Li-Ionen-Akkus „flach“ zu zyklen, wodurch sich deren Lebensdauer verlängert. Das Entladen unter 40 % sollte vermieden werden, da es bei „tiefen Zyklen“ zu größeren Kapazitätsverlusten aufgrund irreversibler Reaktionen in den Elektroden kommen kann. Der Akku altert schneller, je höher seine Zellenspannung ist, daher ist es zu vermeiden, einen Li-Ion-Akku ständig 100 % geladen zu halten.
- Überladung
- Bei einem Überladungsversuch wird der Akku durch seine Überwachungselektronik von den äußeren Kontakten getrennt, bis die zu hohe Spannung nicht mehr anliegt. Danach kann er meist ohne Probleme wieder verwendet werden. Bei Überladung eines Li-Ion-Akkus lagert sich metallisches Lithium an der Anode ab. Das Kathodenmaterial wird zum oxidierenden Element und verliert seine Stabilität. Dadurch heizt sich der Akku auf und kann sogar in Brand geraten. [5]
- Tiefentladung
- Bei einer Tiefentladung schaltet eine interne Sicherung den Akku, meist nur temporär, ab. Es liegt dann an den externen Kontakten des Akkupacks überhaupt keine Spannung mehr an, d. h., er kann nicht noch weiter entladen werden. Leider weigern sich etliche Ladegeräte, einen derartig defekt anmutenden Akku wieder zu laden, da in diesem Fall an den externen Kontakten nur eine Spannung von 0 Volt messbar ist. Der Akku wird jedoch von seiner Schutz-Elektronik wieder an die Kontakte geschaltet, sobald eine äußere Spannung anliegt. In solchen Fällen kann es helfen, ein anderes Ladegerät zu verwenden. Wenn eine Zelle auf unter 1,5 V entladen wird, sollte sie nicht mehr verwendet werden. Denn mit hoher Wahrscheinlichkeit haben sich Kupferbrücken ausgebildet, die zu einem Kurzschluss führen. Die Zelle wird instabil und erhitzt sich stark. Es besteht Brandgefahr.
- Ladegeräte
- Herkömmliche Li-Ionen-Akkus dürfen nur mit einer speziellen Ladeschaltung geladen werden. Die Elektronik steuert den ladungsabhängigen Ladestrom und überwacht insbesondere die exakt einzuhaltende Ladeschlussspannung. Auch bei vorhandener interner Schutzschaltung sollte nur mit passenden Geräten geladen werden. Schnell-Ladegeräte sollten immer unter Aufsicht und möglichst nicht in der Nähe brennbarer Materialien benutzt werden.
- Integrierte Elektronik
- Li-Ion-Akkus reagieren sehr empfindlich auf falsche Behandlung, weshalb dieser Akkutyp lange Zeit nicht eingesetzt wurde, obwohl er bereits Anfang des 20. Jahrhunderts erfunden wurde. Integrierte Schaltkreise sind sehr preisgünstig geworden; daher können Li-Ion-Akkus heute in Verbindung mit einer Elektronik (BMS = Battery Management and Monitoring System) betrieben werden, was die Sicherheit im Umgang mit diesem Akkutyp erheblich erhöht hat. Bei Akku-Packs kleiner und mittlerer Baugröße ist diese Elektronik meist integriert; sie dient zum Schutz gegen Tiefentladung, Überladung und thermische Überlastung. Eine selbstrückstellende Sicherung verhindert Überstrom bzw. Kurzschluss. Die verwendete Prozessorsteuerung ist auf die Eigenschaften des jeweiligen Akkutyps abgestimmt. Akku-Packs, in denen zur Spannungserhöhung mehrere Zellen in Reihe geschaltet werden, verfügen oft auch über eine Elektronik, die durch sog. Cell-Balancing-Ladung und -Entladung für jede einzelne Zelle individuell regelt. [8] [9]
- Betriebs- und Umgebungstemperatur
- Da bei Kälte die chemischen Prozesse (auch die Zersetzung des Akkus bei der Alterung) langsamer ablaufen und die Viskosität der in Li-Zellen verwendeten Elektrolyte stark zunimmt, erhöht sich auch beim Lithium-Ionen-Akku bei Kälte der Innenwiderstand, womit die abgebbare Leistung sinkt. Zudem können die verwendeten Elektrolyte bei Temperaturen um −25 °C einfrieren. Manche Hersteller geben den Arbeitsbereich mit 0–40 °C an. Optimal sind 18–25 °C. Unter 10 °C kann durch den erhöhten Innenwiderstand die Leistung so stark nachlassen, dass sie nicht lange für den Betrieb eines Camcorders oder einer Digitalkamera ausreicht. Es gibt aber Li-Ionen-Akkus mit speziellen Elektrolyten, die bis −54 °C eingesetzt werden können.
- Lagerung
- Der Ladezustand soll 40–60 % betragen, kühle Lagerung ist vorteilhaft. Die Elektrolyte in der Zelle dürfen nicht gefrieren, was einer Mindesttemperatur um −25 °C entspricht. Hersteller empfehlen eine Lagerung bei 15 °C bei einem Ladestand von 60 % – ein Kompromiss zwischen beschleunigter Alterung und Selbstentladung. Andere Quellen empfehlen dagegen 40 % Ladestand und möglichst niedrige Temperatur, also z. B. Kühl- oder Gefrierschrank.[10] Ein Akku sollte etwa alle sechs Monate auf 40–60 % nachgeladen werden. Zur Zeit gilt die Faustregel, dass ein Li-Ionen-Akku nach ca. drei Jahren mehr als 50 % seiner Kapazität eingebüßt hat. Lithium-Ionen-Akkumulatoren dürfen sich auch bei Lagerung nicht unter 2,5 V pro Zelle entladen.
Permanenter Kapazitätsverlust in Abhängigkeit von Umgebungstemperatur und Ladezustand (Quelle: [5]) Umgebungstemperatur 40 % Ladung 100 % Ladung 0 °C 2 % Verlust nach einem Jahr 6 % Verlust nach einem Jahr 25 °C 4 % Verlust nach einem Jahr 20 % Verlust nach einem Jahr 40 °C 15 % Verlust nach einem Jahr 35 % Verlust nach einem Jahr 60 °C 25 % Verlust nach einem Jahr 40 % Verlust nach einem Jahr Gefahren beim Umgang mit Li-Ionen-Akkus
Viele der im Folgenden aufgeführten Risiken, die beim Umgang mit klassischen Li-Ionen-Akkus zu beachten sind, konnten bei den neuesten Weiterentwicklungen durch die Verwendung keramischer Separatoren eliminiert werden.
- Mechanische Belastung
- Mechanische Beschädigungen können zu inneren Kurzschlüssen führen. Die hohe Stromstärke lässt das Gehäuse schmelzen und in Flammen aufgehen. Unter Umständen ist der Defekt nicht unmittelbar zu erkennen. Auch 30 Minuten nach der Beschädigung kann es noch zum Brand kommen.
- Chemische Reaktionen
- Lithium ist ein hochreaktives Metall. Auch wenn es wie bei Lithiumbatterien als chemische Verbindung vorliegt, sind die Komponenten eines Li-Ionen-Akkus leicht brennbar. Ausgleichsreaktionen beim Überladen, zum Beispiel die Zersetzung von Wasser zu Knallgas wie bei anderen Akkus, sind nicht möglich. Li-Ionen-Akkus sind zwar hermetisch gekapselt, dennoch sollten sie nicht in Wasser getaucht werden; (defekte) Lithium-Zellen reagieren grundsätzlich heftig mit Wasser [11], insbesondere in vollgeladenem Zustand. Brennende Akkus dürfen daher nicht mit Wasser, sondern sollten zum Beispiel mit Sand gelöscht werden. Die Elektrolytlösung ist meist brennbar. Ausgelaufene Elektrolytlösung eines Li-Ionen-Akkus kann fern von diesem mit Wasser abgewaschen werden.
- Thermische Belastung
- Kraftfahrzeuge mit Hybridantrieb werden bislang mit Nickel-Metallhydrid-Akkumulatoren betrieben, weil Lithium-Ionen-Akkumulatoren zuweilen für Autos nicht sicher genug sind. Bei thermischer Belastung kann es in den Lithium-Ionen-Batterien zu einem Schmelzen des Separators und damit zu einem Kurzschluss mit verheerenden Folgen kommen. Neuartige keramische und temperaturbeständigere Separatoren gewähren allerdings eine erhöhte Sicherheit.
- Brand
- Interne Schutzschaltungen wie Temperatursensoren oder eine Spannungsüberwachung sollen bei Überladung oder Überlastung eine Entzündung der brennbaren Elektrolytlösung verhindern. Falls allerdings keine Schutz-Elektronik vorhanden oder selbige defekt ist, kann der Akku Feuer fangen. Li-Ionen-Akkus dürfen, wie andere Akkumulatoren auch, nicht kurzgeschlossen werden. Durch Kurzschluss (auch mit Metallschmuck oder Werkzeugen) können Feuer oder Verbrennungen verursacht werden. Moderne Li-Ionen-Phospat-Zellen sind durch Keramikfolien besser gegen Überladen und mechanische Beschädigung abgesichert.
Anwendungsbereiche
Li-Ionen-Akkus versorgen tragbare Geräte mit hohem Energiebedarf, für die herkömmliche Nickel-Cadmium- bzw. Nickel-Metallhydrid-Akkus zu schwer oder zu groß wären, beispielsweise Mobiltelefone, Digitalkameras, Camcorder oder Notebooks sowie Pedelecs, Elektro- und Hybridfahrzeuge. Auch im RC-Modellbausektor haben sie sich etabliert. Neuerdings werden Lithium-Ionen-Akkus bei Elektrowerkzeugen wie zum Beispiel Akkuschraubern verwendet.
Aktuelle Entwicklungen
Im April 2006 schrieb eine Gruppe von Wissenschaftlern des Massachusetts Institute of Technology, einen Prozess entwickelt zu haben, der für die Herstellung von Nanometer-großen Drähten Viren verwendet. Damit können ultradünne Lithium-Ionen-Akkus mit der dreifachen der bisher möglichen Energiedichte hergestellt werden.[12]
Im Juni 2006 stellten Forscher aus Frankreich Batterie-Elektroden in Nanometer-Größe her, die ein Mehrfaches der Energiedichte im Vergleich zu gewöhnlichen Elektroden besaßen.[13]
Im September 2006 berichten Forscher der Universität Waterloo, Canada in der Zeitschrift Nature von einem neuen Kathodenmaterial, bei dem die Hydroxid-Gruppe der Eisenphosphat-Kathode durch Fluorid ersetzt wurde. Dies hat einen doppelten Vorteil: Erstens ergibt sich während eines Ladungszyklus eine geringere Volumenänderung in der Kathode, was eine längere Lebensdauer erwarten lässt. Zweitens erlaubt es den Ersatz des Lithiums durch Natrium bzw. eine Natrium-Lithium-Mischung, weswegen sie auch als Alkali-Ionen-Batterie bezeichnet wird. [14]
Im Dezember 2007 berichteten Forscher der Stanford University von einem neuen Typ von Lithium-Ionen-Akku mit der zehnfachen der bisher möglichen Energiedichte; sie verwendeten Silizium-Nanodrähte auf rostfreiem Stahl als Anodenmaterial [15]. Es wird die Tatsache genutzt, dass Silizium große Mengen an Lithium halten kann; die geringe Größe der Drähte löst das Problem des Aufbrechens der Anode. Zum Erreichen der zehnfachen Energiedichte muss allerdings auch die Kathode verbessert werden. Trotzdem kann nach Auskunft der Forscher die alleinige Verbesserung der Anode die erzielbare Energiedichte um ein Mehrfaches verbessern. Der Leiter des Forschungsteams, Yi Cui, erwartet, dass diese Technologie in ca. 5 Jahren kommerziell erhältlich sein wird. [16].
Am 12. März 2009 wurde eine Weiterentwicklung der Lithium-Ionen-Akkus durch die beiden MIT-Forscher Byoungwoo Kang und Gerbrand Ceder veröffentlicht, die sowohl die Lade- als auch die Entladegeschwindigkeit drastisch (10 Sekunden statt 6 Minuten für einen kleinen Test-Akku) erhöht[17]. Diese Akkus werden voraussichtlich in Kürze kommerziell vertrieben werden, da keine neuen Materialien für die neue Technologie gebraucht werden.
Einzelnachweise
- ↑ a b c itwissen.info
- ↑ Firmengeschichte Sony
- ↑ a b Panasonic
- ↑ Isidor Buchmann, Cadex Electronics Inc
- ↑ a b c d e Batteryuniversity.com
- ↑ qsl.net.de
- ↑ Tecchannel
- ↑ mpower
- ↑ Multi-Cell Li-ion Battery Pack OCP/Analog Front End bei intersil
- ↑ http://batteryuniversity.com/parttwo-34.htm
- ↑ YouTube: Lithium and Water
- ↑ Ki Tae Nam, Dong-Wan Kim, Pil J. Yoo, Chung-Yi Chiang, Nonglak Meethong, Paula T. Hammond, Yet-Ming Chiang, Angela M. Belcher: Virus-Enabled Synthesis and Assembly of Nanowires for Lithium Ion Battery Electrodes. In: Science. 312, Nr. 5775, 2006, S. 885–888 (doi:10.1126/science.1122716).
- ↑ Kevin Bullis: Higher-Capacity Lithium-Ion Batteries - Nanostructured electrodes and active materials could shrink batteries for portable electronics and electric vehicles.Auf: Technology Review
- ↑ B. L. Ellis, W. R. M. Makahnouk, Y. Makimura, K. Toghill, L. F. Nazar: A multifunctional 3.5 V iron-based phosphate cathode for rechargeable batteries. In: Nat Mater. 6, Nr. 10, 2007, S. 749–753 (doi:10.1038/nmat2007).
- ↑ Meldung auf Sciencedaily.com
- ↑ Interview auf der Website gm-volt.com
- ↑ Der Super-Akku – Artikel bei pro-physik.de
Literatur
- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren: Mobile Energiequellen für heute und morgen. Springer, Berlin 1997, ISBN 978-3-5406-2997-9.
- David Linden: Handbook of Batteries (McGraw-Hill Handbooks). 3. Auflage. Mcgraw-Hill Professional, New York 2008, ISBN 978-0-0713-5978-8.
- Wolfgang Weydanz, Andreas Jossen: Moderne Akkumulatoren richtig einsetzen. printyourbook, Neusäss 2006, ISBN 978-3-9393-5911-1.
- J. O. Besenhard: Handbook of Battery Materials. Wiley-VCH, 1998, ISBN 3-527-29469-4.
Weblinks
- Umfangreiche Info über Lithium-Ionen-Akkus in Notebooks
- Skript über diverse Typen von Lithium-Batterien (PDF)
- Berechnung von Verbrauch und Ladezeit
- Lithium-Akkus für Elektroautos – Erfahrungsbericht
- Varta Automotive (Hrsg.): Die Entwicklung der Batterie. Kapitel 7: Lithium-Ionen-Batteriesystem. aufgerufen am 4. Jan. 2009.
- Kapazität von Li-Ionen-Akkus verzehnfacht (tomshardware.com)
- Drahtiges Silizium – Kapazitätserhöhung von Li-Ionen-Akkus (heise.de)
Primärzellen: Alkali-Mangan-Batterie | Daniell-Element | Leclanché-Element | Lithium-Batterie | Lithium-Eisensulfid-Batterie | Nickel-Oxyhydroxid-Batterie | Quecksilberoxid-Zink-Batterie | Silberoxid-Zink-Batterie | Zink-Braunstein-Zelle | Zinkchlorid-Batterie | Zink-Luft-Batterie
Sekundärzellen: Bleiakkumulator | Natrium-Schwefel-Akkumulator | Nickel-Cadmium-Akkumulator | Nickel-Eisen-Akkumulator | Nickel-Metallhydrid-Akkumulator | Nickel-Wasserstoff-Akkumulator | Lithium-Eisen-Phosphat-Akkumulator | Lithium-Ionen-Akkumulator | Lithium-Mangan-Akkumulator | Lithium-Polymer-Akkumulator | Lithium-Titanat-Akkumulator | Vanadium-Redox-Akkumulator
Ausführungen: Akkumulator | Batterie | Brennstoffzelle | Konzentrationselement | Redox-Flow-Zelle | Bestandteile: Halbzelle (Donator- und Akzeptorhalbzelle)
Wikimedia Foundation.


_svg.png)