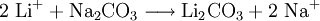- Li2CO3
-
Strukturformel 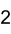

Allgemeines Name Lithiumcarbonat Summenformel Li2CO3 CAS-Nummer 554-13-2 Kurzbeschreibung Weißes Pulver Eigenschaften Molare Masse 73,89 g·mol–1 Aggregatzustand fest
Dichte 2,11 g·cm–3[1]
Schmelzpunkt 720 °C[1]
Siedepunkt ca 1310 °C[2]
Löslichkeit löslich in Wasser: 13 g·l−1 (20 °C) in Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36 S: 24 LD50 525 mg·kg−1[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Lithiumcarbonat (Li2CO3), das Lithiumsalz der Kohlensäure, bildet farblose Kristalle mit einem Schmelzpunkt von 720 °C und einer Dichte von 2,11 g·cm-3. Im Gegensatz zu den Carbonaten der übrigen Alkalimetalle ist Lithiumcarbonat in Wasser schwer löslich. Die Herstellung erfolgt daher durch Umsetzung von wässrigen Lithiumsalzlösungen mit Natriumcarbonat.
Inhaltsverzeichnis
Gewinnung und Darstellung
Lithiumcarbonat wird aus lithiumhaltigen Erzen und Solen hergestellt.
Das lithiumhaltige Erz wird zerkleinert, zur Entfernung organischer Verunreinigungen geröstet und mit Schwefelsäure aufgeschlossen. Durch Zugabe von Natriumcarbonat (Soda) werden zuerst die Verunreinigungen ausgefällt und abfiltriert. Weiteres Alkalisieren mit Natriumcarbonat führt zur Ausfällung von Lithiumcarbonat, das abfiltriert oder abzentrifugiert wird.[3] Bei stark verunreinigtem Ausgangsmaterial wird nochmals mit Schwefelsäure aufgelöst und mit Natriumcarbonat gefällt. Vor dem Verpacken wird das Lithiumcarbonat in einem Vakuumtrockner getrocknet.
Kostengünstiger ist das Verarbeiten von lithiumhaltigen Solen. Vor der Fällung mit Soda werden sie aufkonzentriert. Im Gewinnungsgebiet Salar de Atacama in Chile geschieht dies teilweise durch Verdunsten des Wassers in Solarteichen. Der anschließende Fertigungsweg siehe oben.
Verwendung
Lithiumcarbonat kann als Ausgangsstoff zur Herstellung weiterer Lithiumverbindungen wie beispielsweise Lithiumchlorid, Lithiumhydroxid oder Lithiumniobat verwendet werden. Des Weiteren wird es zur Schmelzpunkterniedrigung in der schmelzflusselektrolytischen Gewinnung von Aluminium genutzt.[3] Lithiumhaltige Gläser werden auf Grund ihres geringen Ausdehnungskoeffizienten zur Herstellung feuerfester Gläser verwendet.[3] Es ist außerdem Bestandteil von Schnellzementen und Estrichen[4] und dient dort dem schnelleren Abbinden des Zements. In Schmelzcarbonatbrennstoffzellen ist es Bestandteil des Elektrolyts.[5] In der Industrie wird es auch als Flussmittel zur Herstellung von Glas, Keramik und Email eingesetzt.[3] Lithiumzusätze verringern Schmelztemperatur und Viskosität. Dadurch können Glasflaschen und Emailschichten geringerer Dicke hergestellt werden. In der Lithiumtherapie wird Lithiumcarbonat zur Behandlung depressiver Erkrankungen, Manien oder bipolarer Störungen eingesetzt. In der chemischen Analytik kann die Anwesenheit von Lithiumionen in einer wässrigen Lösung durch Zugabe eines Alkalimetallcarbonats, beispielsweise Natrium- oder Kaliumcarbonat, geschehen, wobei schlecht wasserlösliches Lithiumcarbonat aus der Lösung als weißer Niederschlag ausfällt.[6]
Sonstiges
Lithiumcarbonat ist Namensgeber des Songs Lithium der Grunge-Band Nirvana. Das Lied spielt auf die Verwendung von Lithiumcarbonat zur Behandlung von depressiven Erkrankungen an. Auch die Band Evanescence veröffentlichte 2006 einen Song namens Lithium.
Quellen
- ↑ a b c d Sicherheitsdatenblatt (carl-roth)
- ↑ a b Eintrag zu Lithiumcarbonat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 8. Nov. 2007 (JavaScript erforderlich)
- ↑ a b c d A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie 1995, 101. Auflage, de Gruyter. ISBN 3-11-012641-9, S. 1153.
- ↑ Institut für Holztechnologie Dresden
- ↑ J. Deberitz, G. Boche: Lithium und seine Verbindungen – Industrielle, medizinische und wissenschaftliche Bedeutung, in: Chemie in unserer Zeit 2003, 37, 258–266.
- ↑ Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. Hirzel, Stuttgart 1995, ISBN 978-3-77-760672-9, S. 387.
Wikimedia Foundation.