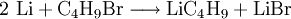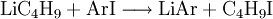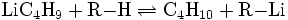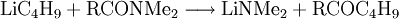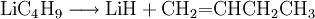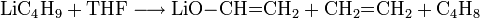- Lithiumbutyl
-
Strukturformel 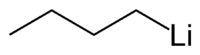
Allgemeines Name Butyllithium Andere Namen - n-Butyllithium
- BuLi
- n-BuLi
- Lithiumbutyl
Summenformel C4H9Li CAS-Nummer 109-72-8 Kurzbeschreibung Pyrophorer Feststoff, meistens nur als Lösung mit gelblicher Farbe erhältlich. Eigenschaften Molare Masse 64,05 g·mol−1 Aggregatzustand fest (meist jedoch in Lösung)
Dichte Schmelzpunkt Siedepunkt 69 °C (2,5 M Lösung in n-Hexan)[1]
Dampfdruck Löslichkeit Löslich in n-Hexan, Cyclohexan und Toluen. Reagiert heftig mit Wasser und Alkoholen.
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 


Leicht-
entzündlichÄtzend Umwelt-
gefährlich(F) (C) (N) bezogen auf 2,5 M Lösung in n-Hexan
R- und S-Sätze R: 11-14/15-17-34-48/20-51/53-62-65-67 S: 7/8-16-26-36/37/39-45-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Unter Butyllithium versteht man in der Regel n-Butyllithium (n-BuLi), eine metallorganische Verbindung des Elements Lithium. Daneben gibt es noch die isomeren Formen sec-Butyllithium und tert-Butyllithium.
Inhaltsverzeichnis
Gewinnung und Darstellung
Die Synthese erfolgt analog zur Herstellung von Grignard-Verbindungen durch Reaktion von 1-Brombutan[2] oder 1-Chlorbutan[3] mit elementarem Lithium in Diethylether:
Eigenschaften
Physikalische Eigenschaften
Reines n-Butyllithium ist ein pyrophorer Feststoff.[2] Daher ist es im Handel als leicht gelbe Lösung erhältlich, wobei Konzentrationen von 1,6 bis 10 mol/l in n-Hexan üblich sind. Etherartige Lösungsmittel wie THF oder Diethylether sind als Lagerlösungsmittel für n-BuLi ungeeignet, da sie langsam zersetzt würden.
Chemische Eigenschaften
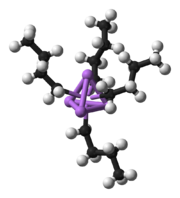
n-Butyllithium ist eine sehr starke Base. Die Basizität der isomeren Butyllithiumverbindungen nimmt in der Reihe n-Butyllithium < sec-Butyllithium < tert-Butyllithium zu. Durch die große Elektronegativitätsdifferenz zwischen Kohlenstoff (2,55) und Lithium (0,98) ist die Bindung zwischen C und Li stark polarisiert. Aufgrund der Reaktionen von n-BuLi könnte man davon ausgehen, dass sich n-BuLi aus dem Butylanion und dem Lithiumkation zusammensetzt, also eine Ionenbindung besitzt. Diese Annahme ist jedoch falsch, denn n-BuLi ist nicht ionisch. Als Feststoff und sogar als Lösung existiert n-BuLi, wie die meisten Organolithiumverbindungen, als Molekülgruppen mit kovalenten Bindungen zwischen Lithium und Kohlenstoff. Im Falle von n-Buli sind diese tetramerisch (in Ether) oder hexamerisch (in Cyclohexan) angeordnet.
Reaktionen
Lithium-Halogen-Austausch: Das Halogen in einer Verbindung kann gegen Lithium ausgetauscht werden. Dieses ergibt Reagenzien mit nukleophilen Kohlenstoffzentren, welche für die Herstellung von zahlreichen Verbindungen verwendet werden können. Den Austausch nimmt man in der Regel in Ether bei −78°C vor:
Als starke Base (die konjugierte Säure ist Butan!) kann n-BuLi Amine und C-H-azide Verbindungen deprotonieren:
n-Buli kann für die Herstellung von bestimmten Aldehyden und Ketonen aus disubstituierten Amiden verwendet werden:
Beim Erhitzen von n-BuLi, findet eine β-Eliminierung statt. Hierdurch entstehen Buten und Lithiumhydrid:
Lagert man n-BuLi oder t-BuLi längere Zeit als etherische Lösung, z.B. in Tetrahydrofuran, so findet ein Zerfall des Lösungsmittels statt:[4]
Verwendung
n-BuLi hat in der modernen synthetischen organischen Chemie große Bedeutung als ultrastarke Base bzw. als Lithiierungsreagenz erlangt. So wird z. B die häufig verwendete Base Lithiumdiisopropylamid (LDA) in der Regel in situ durch Deprotonieren von Diisopropylamin mit n-BuLi in THF hergestellt.
Sicherheitshinweise
Wie bereits erwähnt, ist reines n-BuLi äußerst pyrophor. Aber auch die Lösungen, insbesondere wenn sie höher konzentriert sind, können sich spontan entzünden. Sie reagieren zudem heftig mit Wasser zu Lithiumhydroxid und Butan. Durch längeres Stehen kann sich daher in den Lösungen ein Niederschlag bilden, der durch Eindringen von Feuchtigkeit entsteht. Es kann sich aber auch um Lithiumhydrid handeln, da n-BuLi sehr langsam in Buten und Lithiumhydrid zerfällt.
Einzelnachweise
- ↑ a b c d Eintrag zu CAS-Nr. 109-72-8 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 28. Februar 2007 (JavaScript erforderlich).
- ↑ a b Autorenkollektiv: Organikum. 21. Auflage. Wiley-VCH Weinheim, 2001, ISBN 3-527-29985-8, S.746–747.
- ↑ K. Ziegler, H. Colonius: Untersuchungen über alkali-organische Verbindungen. V. Eine bequeme Synthese einfacher Lithiumalkyle, in: Justus Liebigs Ann. Chem. 1930, 479, 135–149.
- ↑ Jonathan Clayden und Samreen A. Yasin: "Pathways for decomposition of THF by organolithiums: the role of HMPA", in: New J. Chem. 2002, 26, 191–192; doi:10.1039/b109604d.
Literatur
- Autorenkollektiv: Organikum. 21. Auflage. Wiley-VCH Weinheim, 2001, ISBN 3-527-29985-8.
- Christoph Elschenbroich: Organometallchemie. 5. Auflage, Teubner Wiesbaden 2005, ISBN 3-519-53501-7.
Wikimedia Foundation.