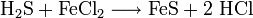- Martinswasser
-
Strukturformel 
Allgemeines Name Schwefelwasserstoff Andere Namen - Wasserstoffsulfid
- Dihydrogensulfid
- Martinswasser
- Sauergas
- Sulfan
Summenformel H2S CAS-Nummer 7783-06-4 Kurzbeschreibung farbloses, nach faulen Eiern riechendes Gas Eigenschaften Molare Masse 34,08 g·mol−1 Aggregatzustand gasförmig
Dichte 1,5359 kg·m−3 (0 °C)[1]
Schmelzpunkt Siedepunkt −60,20 °C[1]
Dampfdruck 18,190 bar (20 °C)[1]
pKs-Wert Löslichkeit Wasser (0 °C, 1 bar): 4,65 l/l[1]
wenig in org. LösungsmittelnSicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 


Sehr giftig Hoch-
entzündlichUmwelt-
gefährlich(T+) (F+) (N) R- und S-Sätze R: 12-26-50 S: (1/2)-9-16-36-38-45-61 MAK 5 ml·m−3[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Schwefelwasserstoff (Wasserstoffsulfid, Dihydrogensulfid*) ist ein übel riechendes, stark giftiges Gas. Es ist eine Verbindung aus Schwefel und Wasserstoff mit der chemischen Formel H2S. Schwefelwasserstoff verursacht schon in extrem geringen Konzentrationen den typischen Geruch von faulen Eiern, der bei der Zersetzung von Proteinen aus schwefelhaltigen Aminosäuren durch Fäulnis- und Schwefelbakterien entsteht.
Schwefelwasserstoff ist brennbar, farblos und in Wasser wenig, in Alkohol etwas besser löslich. Er ist eine schwache Säure, deren Salze die Sulfide und Hydrogensulfide sind.
*Nicht zu verwechseln mit dem Hydrogensulfid-Anion HS−, welches oft auch „Hydrogensulfid“ genannt wird (siehe Sulfide).
Inhaltsverzeichnis
Vorkommen
In der Natur kommt Schwefelwasserstoff als sehr variabler Bestandteil (von Spuren bis zu 80 Vol-%) in Erdgas und in Erdöl, als vulkanisches Gas und in Quellwasser gelöst vor. Es entsteht außerdem bei Fäulnis- und Zersetzungsprozessen durch den Abbau von Biomasse (z. B. Tierkadaver, Zersetzung der Laubstreu, Faulschlammbildung am Grund eutropher Seen usw.), Mülldeponien, Abwasserhochdruckleitungen oder bei Verdauungsvorgängen im Darm, den es mit dem Flatus verlässt. Im Volksmund wird der Schwefelwasserstoff daher auch häufig als „Martinswasser“ bezeichnet.
Gewinnung und Darstellung
Schwefelwasserstoff lässt sich im Labormaßstab herstellen, indem man Salzsäure auf Eisensulfid tropft.
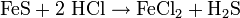
- Aus Eisensulfid und Salzsäure entsteht Eisen(II)-chlorid und Schwefelwasserstoff.
Das so entstehende Produkt ist allerdings durch die Ausgangsprodukte mit Gasen wie Wasserstoff, Kohlendioxid, Arsin, Stickstoff und Sauerstoff verunreinigt. Reiner Schwefelwasserstoff kann durch Erhitzen einer konzentrierten Magnesiumhydrogensulfid-Lösung oder aus den Elementen, oder aus Natriumsulfid und Phosphorsäure erhalten werden.[4]
In der Petrochemie (Raffinerien) fällt Schwefelwasserstoff in großen Mengen bei der Hydrodesulfurierung von Erdöl an.
Eigenschaften
Physikalische Eigenschaften
- kritische Temperatur: 100,4 °C
- kritischer Druck: 90,1 bar
Thermodynamik:
S0g, 1 bar: 205,77 J/(mol·K)
In 1 l Wasser lösen sich bei Raumtemperatur bis zu 2,582 l Schwefelwasserstoffgas.
Schwefelwasserstoff ist geringfügig schwerer als Luft, unter Normalbedingungen beträgt der Dichteunterschied etwa 19%.
Chemische Eigenschaften
Mit einem pKs-Wert von 6,9 ist Schwefelwasserstoffsäure – ähnlich wie Hydrogensulfit – eine recht schwache Säure. Die wässrige Lösung reagiert mit vielen Schwermetallsalzen zu unlöslichen Sulfiden, was man sich im Kationentrenngang zunutze macht. Entsprechend wird das Gas mit Bleiacetatpapier nachgewiesen, da es mit Blei(II)-Ionen zu schwarzem Bleisulfid (PbS) reagiert. Ebenso reagiert es mit Eisen(II)-Ionen zu schwarzem Eisensulfid (FeS).
Die obige Reaktion zur Gewinnung ist auch umkehrbar. Bei natürlichen Bedingungen (pH 5–10) kann man Schwefelwasserstoff in wässriger Lösung mit Eisen(II)-chlorid zu Eisensulfid binden.
Dies ist bei Biogas, Faulgas und im Abwasserkanal gängige Praxis. Man macht sich die große Affinität von Eisen zu Schwefel zunutze, um Biogas und Faulgas zu reinigen. Hier würde bei der weiteren Verwendung in Gasmotoren das nach der Verbrennung entstehende Schwefeldioxid erhebliche Korrosionsprobleme verursachen.
Schwefelwasserstoff verbrennt bei Luftzufuhr mit blauer Flamme zu SO2 und Wasser, wobei unter anderem schweflige Säure (H2SO3) entsteht. Aus der wässrigen Lösung scheidet sich bei Luftzufuhr allmählich Schwefel ab.
Mit Schwefeldioxidgas komproportioniert es in Anwesenheit von Wasserdampf zu Schwefel und Wasser (Rauchgasentschwefelung, Redoxreaktion), mit Chlorgas bildet sich Schwefel und Chlorwasserstoffgas (Salzsäure). Schwefelwasserstoffgas ist zudem ein kräftiges Reduktionsmittel.
Verwendung
Großchemie
Schwefelwasserstoff ist die Hauptquelle für elementaren Schwefel (Claus-Prozess), welcher wiederum zu über 95 % zu Schwefelsäure umgesetzt wird.
Chemische Analytik
Im klassischen Kationentrenngang wird es zum Ausfällen einer ganzen Gruppe benutzt (Schwefelwasserstoffgruppe). Durch Einleiten von H2S-Gas in schwach saure Lösungen fallen aus: As2S3, SnS2, Sb2S3, HgS, SnS, PbS, Bi2S3, CuS und bei Verdünnen mit Wasser auch CdS. Diese Kationen sind dann weiter aufzutrennen und mithilfe von Nachweisreaktionen zu identifizieren.
Wegen seiner Giftigkeit wird im Kationen-Trennungsgang zunehmend auf Schwefelwasserstoff verzichtet. Stattdessen werden die benötigten Sulfid-Anionen in situ erzeugt, zum Beispiel mit Hilfe von Thioacetamid, in kleineren Mengen auch durch Erhitzen von Schwefel mit Kerzenwachs.
H2S-Gang: Dieses Verfahren baut auf dem klassischen Trennungsgang auf. Durch spezifische Reagenzien werden chemisch ähnliche Kationen gruppenweise zur Fällung gebracht. Der Niederschlag wird in weiterer Folge aufgetrennt und analysiert, mit dem Überstand (der Lösung) wird weitergearbeitet und daraus die nächste Gruppe zur Fällung gebracht.
Sicherheitshinweise
Besondere Gefahr für den Menschen
Klassifikation nach ICD-10 T59 Toxische Wirkung sonstiger Gase, Dämpfe oder sonstigen Rauches T59.6 Schwefelwasserstoff ICD-10 online (WHO-Version 2006) Schwefelwasserstoff ist ein äußerst giftiges Gas, das zur Schwefelwasserstoffvergiftung führen kann.
Schwefelwasserstoff hat die Eigenschaft, die Geruchsrezeptoren zu betäuben, wodurch man eine Erhöhung der Konzentration nicht mehr über den Geruch wahrnimmt. Der Schwellwert für die Betäubung der Geruchsrezeptoren liegt bei einer Konzentration von >200 ppm H2S.[5] Zugleich sammelt sich das Gas durch seine hohe Dichte am Boden.
Kurzfristige Giftwirkung
Der Schwefelwasserstoff bildet bei Kontakt mit Schleimhäuten und Gewebeflüssigkeit im Auge, der Nase, des Rachens und in der Lunge Alkalisulfide, die eine sehr starke Reizwirkung verursachen. Mit eine Folge sind Wassereinlagerungen in der Lunge. Die Symptome verschwinden gewöhnlich innerhalb weniger Wochen.
Die eigentliche Giftwirkung beruht auf einer Zerstörung des roten Blutfarbstoffes Hämoglobin und damit einer Lähmung der intrazellulären Atmung. Der Mechanismus ist bis heute unklar, es wird vermutet, dass allgemein schwermetallhaltige, sauerstoffübertragende Enzyme inaktiviert werden. Der kleinere, nichtoxidierte Teil des Schwefelwasserstoffs kann Schäden im zentralen und evtl. auch peripheren Nervensystem hervorrufen.
Auf den Menschen ergeben sich folgende Wirkungen:
- ab 20 ppm: Hornhautschäden bei längerer Einwirkung
- ~ 100 ppm: Reizung der Schleimhäute an Auge und Atemwege, Speichelfluss, Hustenreiz
- > 200 ppm: Kopfschmerz, Atembeschwerden
- > 250 ppm: Betäubung der Geruchsrezeptoren
- > 300 ppm: Brechreiz
- ~ 500 ppm: Kraftlosigkeit, Benommenheit, Schwindel
- > 500 ppm: Krämpfe, Bewusstlosigkeit
Langzeit-Einwirkung unter niedrigen Dosen kann zu Müdigkeit, Appetitlosigkeit, Kopfschmerzen, Gereiztheit, Gedächtnisschwäche und Konzentrationsschwäche führen.
Auf den Menschen ergeben sich konzentrationsabhängig Vergiftungserscheinungen:
- < 100 ppm: nach mehreren Stunden
- > 100 ppm: < 1 h
- ~ 500 ppm: lebensgefährlich in 30 min
- ~ 1.000 ppm: lebensgefährlich in wenigen Minuten
- ~ 5.000 ppm: tödlich in wenigen Sekunden
Das bedeutet, dass H2S-Konzentrationen von 0,1 % nach wenigen Minuten und solche von 0,5 % nach wenigen Sekunden tödlich wirken! Bewusstseinsverlust tritt bei solchen Konzentrationen schon innerhalb eines oder mehrerer Atemzüge ein.
Langzeitwirkung
Tierstudien zeigen, dass Schweine, die mit schwefelwasserstoffhaltigen Nahrungsmitteln gefüttert wurden, nach einigen Tagen an Diarrhoe leiden und einen Gewichtsverlust nach etwa 105 Tagen zeigen.
Heilende Wirkung
Schwefelwasserstoff wird in einigen Kurbädern – z. B. in Aachen, Heilbronn, Bad Tölz, Bad Homburg und Tiflis – in geringen, nicht gesundheitsgefährdenden, aber dennoch mit der Nase wahrnehmbaren Mengen in Heilwässer eingesetzt. Es ist Quellwasser mit natürlichem Gehalt an Schwefelwasserstoff und kann bei Hautkrankheiten heilend wirken.
In einer Studie von 2007 an der University of Alabama at Birmingham, die im Fachblatt Proceedings of the National Academy of Sciences veröffentlicht wurde, ist Schwefelwasserstoff in sehr geringer Dosis vermutlich auch als wesentlicher Faktor für die gesundheitliche Wirkung von Knoblauch verantwortlich. Die Autoren berichten, dass Knoblauch das Risiko für Herzerkrankungen durch Bluthochdruck, erhöhtes Blutfett (Cholesterin) und andere Faktoren senkt. In Bevölkerungsgruppen, die viel Knoblauch verzehren, gebe es daher auch weniger Probleme mit zu hohem Blutdruck. [6]
Neuere Forschungsergebnisse zeigen, dass Schwefelwasserstoff möglicherweise als Mittel gegen Erektionsstörungen Anwendung finden könnte. Schwefelwasserstoff fungiert im menschlichen Körper ähnlich wie Stickstoffmonoxid als Botenstoff und wirkt vasodilatativ. Es wird natürlich in den Schwellkörpern des Penis und der glatten Muskulatur der Penis-Arterie aus L-Cystein über die Enzyme Cystathionin-β-Synthase[7] (CBS) und Cystathionin-γ-Lyase[8] (CGL) produziert. Versuche zeigten, dass sowohl L-Cystein als auch Schwefelwasserstoff(-Salz) extern zugeführt eine konzentrationsabhängige Erektion in den Penisschwellkörpern (Corpora cavernosa penis) verursachen. [9][10]
Bitte beachte den Hinweis zu Gesundheitsthemen! Nachweis
H2S schwärzt Bleiacetat-Lösung. Die einfachere Variante ist angefeuchtetes Bleiacetat-Papier.
Quellen
- ↑ a b c d e f Eintrag zu Schwefelwasserstoff in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 3.9.2007 (JavaScript erforderlich)
- ↑ a b pKa Data Compiled by R. Williams
- ↑ Eintrag zu CAS-Nr. 7783-06-4 im European chemical Substances Information System ESIS
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 344-6.
- ↑ Schwefelwasserstoff in: Römpp Chemie-Lexikon, Thieme, 2008
- ↑ Gloria A. Benavides, Giuseppe L. Squadrito, Robert W. Mills, Hetal D. Patel, T. Scott Isbell, Rakesh P. Patel, Victor M. Darley-Usmar†, Jeannette E. Doeller und David W. Kraus: Hydrogen sulfide mediates the vasoactivity of garlic PNAS 104/46/2007. doi:10.1073/pnas.0705710104 S. 17977-17982 (Englisch).
- ↑ Cystathionine β-synthase (EC 4.2.1.22) bei Expasy.org
- ↑ Cystathionine γ-lyase (EC 4.4.1.1) bei Expasy.org
- ↑ Roberta d'Emmanuele di Villa Biancaa, Raffaella Sorrentinoa, Pasquale Maffiaa, Vincenzo Mironeb, Ciro Imbimbob, Ferdinando Fuscob, Raffaele De Palmad, Louis J. Ignarroe und Giuseppe Cirino: Hydrogen sulfide as a mediator of human corpus cavernosum smooth-muscle relaxation, PNAS 2009. doi:10.1073/pnas.0807974105 (englisch), PMID 19255435 (englisch).
- ↑ Artikel: Schwefelwasserstoff als neues Viagra?
Literatur
- Marcel Gerbersmann: Der Schwefel – 101. Beispiele. Herlitz Verlag, 2003
- D. Weismann, M. Lohse (Hrsg.): Sulfid-Praxishandbuch der Abwassertechnik; Geruch, Gefahr, Korrosion verhindern und Kosten beherrschen! 1. Auflage, VULKAN-Verlag, Deutschland 2007, ISBN 978-3-8027-2845-7
Weblinks
Wikimedia Foundation.