- 3,4,9,10-Perylentetracarbonsäuredianhydrid
-
Strukturformel 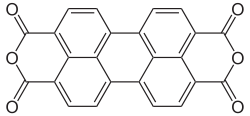
Allgemeines Name PTCDA Andere Namen - 3,4,9,10-Perylen-tetracarbonsäure- dianhydrid
- C.I. 71127
- C.I. Pigment Red 224
Summenformel C24H8O6 CAS-Nummer 128-69-8 PubChem 67191 Kurzbeschreibung roter Feststoff Eigenschaften Molare Masse 392,32 g·mol−1 Aggregatzustand fest
Schmelzpunkt 300 °C [1]
Löslichkeit unlöslich in Wasser und organischen Lösungsmitteln (normalerweise wird konz. Schwefelsäure als Lösungsmittel verwendet)
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-36 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 3,4,9,10-Perylentetracarbonsäuredianhydrid (PTCDA) ist ein Pigment, das in der Entwicklung organischer Halbleiter-Bauelemente verwendet und von der Farbmittel-Industrie für kommerzielle Anwendungen hergestellt wird.
Es basiert in seiner molekularen Struktur auf dem polycyclischen aromatischen Kohlenwasserstoff Perylen, besitzt im Gegensatz zu diesem jedoch sechs Sauerstoff-Heteroatome.
Von der Kristallstruktur[2] sind zwei Modifikationen bekannt (alpha und beta)[3]. Die zweidimensionale Struktur von PTCDA-Schichten, die sich durch Molekularstrahlepitaxie erzeugen lässt, wurde auf verschiedenen Substraten mittels Rastertunnelmikroskopie eingehend untersucht, darunter Graphit, Molybdändisulfid (MoS2)[4] und Kupfer.[5]
Eigenschaften
PTCDA ist ein planares Molekül mit einem zweidimensional konjugierten π-Elektronensystem, welches über das gesamte Perylengerüst delokalisiert ist.[6] Das Anhydrid ist ein organischer Halbleiter (n-Leiter)[7] aus der Gruppe der zweidimensional kondensierten Ringsysteme.
Verwendung
Als organischer Halbleiter lässt sich PTCDA z.B. für die Herstellung von organischen Feldeffekttransistoren[8] verwenden. Derivate der PTCDA lassen sich als Schicht in organischen Solarzellen[9] einsetzen oder dienen als Adsorbat zur Sensibilisierung von Titandioxid-Solarzellen für sichtbares Licht.[10] PTCDA eignet sich zudem als Photokatalystor zur Sauerstoff-Produktion aus Wasser mittels Sonnenenergie.[11]
Als Pigment wird PTCDA vor allem als hochwertiger Industrie-Lack, insbesondere im Automobil-Bereich, eingesetzt.[12]
Quellen
- ↑ a b Datenblatt von Sigma-Aldrich
- ↑ T. Ogawa et al.: 3,4:9,10-Perylenetetracarboxylic dianhydride (PTCDA) by electron crystallography. In: Acta Cryst. B55, 1999, S. 123–130.
- ↑ H. P. Wagner et al: Exciton emission in PTCDA films and PTCDA/ Alq3 multilayers. In: Physical Review B 70, 2004, S. 235201.
- ↑ C. Ludwig et al.: STM investigations of PTCDA and PTCDI on graphite and MoS2. A systematic study of epitaxy and STM image contrast. In: Z. Phys. B 93, 1994, S. 365–373.
- ↑ Wagner et al.: The initial growth of PTCDA on Cu(111) studied by STM in J. Phys.: Condens. Matter 19, 2007, S. 056009 doi:10.1088/0953-8984/19/5/056009
- ↑ T. Ertl. In: Alkalimetall-Dotierung von Perylentetracarbonsäuredianhydrid (PTCDA), Dissertation, 2001, S. 15
- ↑ R. Hudej, G. Bratina: Electronic transport in perylenetetracarboxylic dianhydride: The role of In diffusion. In: J. Vac. Sci. Technol. A 20, Nr. 3, 2002, S. 797–801 (2002).
- ↑ A. Dodabalapur et al.: Molecular Orbital Energy Level En-gineering in Organic Transistors. In: Advanced Materials 8, Nr. 10, 1996, S. 853–855.
- ↑ C. W. Tang: Two-layer organic photovoltaic cell. In: Appl. Phys. Lett. 48, Nr. 2, 1986, S. 183–185.
- ↑ S. Ferrere, B. A. Gregg: New perylenes for dye sensitization of TiO2. In: New J. Chem. 26, 2002, S. 1155–1160.
- ↑ C. A. Linkous, D. K Slattery: Solar photocatalytic hydrogen production from water using a dual bed photosystem. In: Proceedings of the 2000 Hydrogen Program Annual Review, Volume I.
- ↑ W. Herbst, K. Hunger: Industrielle Organische Pigmente. Herstellung, Eigenschaften, Anwendung. 2. Aufl., Wiley-VCH, Weinheim 1995. ISBN 3527287442
Wikimedia Foundation.
