- Metall
-
Dieser Artikel behandelt chemische Elemente, zum wappenkundlichen Begriff siehe Tingierung, die ukrainische Fachzeitschrift findet sich unter Metall (Zeitschrift). - elektrische Leitfähigkeit, die mit steigender Temperatur abnimmt,
- hohe Wärmeleitfähigkeit,
- Duktilität (Verformbarkeit) und
- metallischen Glanz (Spiegelglanz).
- Die Zahl der Elektronen in der äußeren Schale ist gering und kleiner als die Koordinationszahl
- Die (zur Abspaltung dieser Außenelektronen nötige) Ionisierungsenergie ist klein (< 10 eV)
- Glanz (Spiegelglanz)
- Die frei beweglichen Elektronen können fast die gesamte auftreffende elektromagnetische Strahlung bis zu Wellenlängen der Röntgenstrahlung wieder emittieren; so entstehen der Glanz und Reflexion; aus glatten Metallflächen werden deshalb Spiegel angefertigt.
- Undurchsichtigkeit
- Die vorbeschriebene, an der Metalloberfläche stattfindende Reflexion und die Absorption des nicht reflektierten Anteiles bewirken, dass zum Beispiel Licht kaum in Metall eintreten kann. Metalle sind deshalb nur in dünnsten Schichten etwas lichtdurchlässig und erscheinen in der Durchsicht grau oder blau.
- Die Wanderung der frei beweglichen Elektronen in eine Richtung ist der elektrische Strom.
- Die leicht verschiebbaren Elektronen nehmen an der Wärmebewegung teil. Sie übertragen zudem die thermische Eigenbewegung der Atomrümpfe (Schwingungen) und tragen so zum Wärmetransport bei, vgl. Wärmeleitung.
- Gute Verformbarkeit (Duktilität)
- Im Metall befinden sich Korngrenzen und Versetzungen, die sich schon bei einer Dehnung unterhalb der Bruchdehnung bewegen können, das heißt, ohne dass der Zusammenhalt verloren geht; je nach Gittertyp verformt sich also ein Metall, bevor es bricht.
- Relativ hoher Schmelzpunkt
- Er resultiert aus den allseitig gerichteten Bindungskräften zwischen den Kationen und den frei beweglichen Elektronen, ein jedoch weniger starker Effekt als die elektrostatischen Anziehungskräfte zwischen Ionen in Salzkristallen.
-
Schmelz- und Siedetemperaturen einiger Metalle (bei Normaldruck) [2] Metall Schmelztemperatur
in °CSiedetemperatur
in °CAluminium 660,3 2519 Blei 327,4 1749 Eisen 1538,0 2861 Gold 1064,2 2856 Kupfer 1084,6 2562 Magnesium 650,0 1090 Wolfram 3422,0 5555 Zink 419,5 907 (weißes) Zinn 231,9 2602 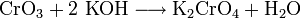
- Chromtrioxid löst sich in Kalilauge unter Bildung von Kaliumchromat und Wasser.
- Aluminium: bedeutendstes Leichtmetall
- Beryllium: Legierungen, vor allem mit Kupfer und Aluminium; Waffentechnik
- Bismut: Legierungen
- Blei: Legierungen, Bleiakkumulator, Lote, Korrosionsschutz, Gewicht
- Cadmium: Bestandteil von Akkumulatoren
- Chrom: Legierungsbestandteil (Chrom-Vanadium-Stahl, Chrom-Nickel-Stahl), Überzugsmetall
- Eisen: wichtigstes Werkmetall (Gusseisen, Stahl), viele Legierungen
- Gallium: Halbleiter
- Gold: Schmuckmetall, Blattgold, Elektrotechnik, Wertanlage, Währungsabsicherung
- Indium: Halbleiter, Indiumdichtung
- Iridium: Elektroden, Zündkerzen, Kugelschreiberminen (Kugeln)
- Kalium: legiert mit Natrium als Kühlmittel in Kernreaktoren
- Cobalt: Magnete
- Kupfer: Elektrotechnik (zweithöchste Leitfähigkeit nach Silber), Bronze, Messing
- Magnesium: für besonders leichte Werkstücke mit nicht allzuhohen Ansprüchen an die Festigkeit; Einweg-Blitzbirnen bzw. Blitzlichtpulver
- Mangan: Legierungsbestandteil (Manganstahl)
- Molybdän: Legierungsbestandteil (Molybdän-Stahl) zur Erhöhung der Warmfestigkeit
- Natrium: legiert mit Kalium als Kühlmittel in Kernreaktoren
- Nickel: Legierungen (Nickel-Eisen, Nickel-Chrom, Nickel-Kupfer etc.), Legierungsbestandteil (Chrom-Vanadium-Stahl, Chrom-Nickel-Stahl), Magnete
- Osmium: legiert mit Wolfram in Glühlampen
- Palladium: Katalyse, Wasserstoffspeicherung
- Platin: Schmuckmetall, Katalyse, wertvollstes Metall
- Quecksilber: Thermometer
- Rhodium: Schmuckmetall
- Ruthenium: Katalysator, Erhöhung des Härtegrades von Platin und Palladium
- Silber: Schmuckmetall, Fotografie
- Tantal: Kondensatoren
- Titan: für Leichtbauweise ohne Rücksicht auf die Kosten, Schmuck
- Uran: Kernreaktoren, Radioaktivität, Geschosse
- Vanadium: Legierungsbestandteil (Chrom-Vanadium-Stahl) für wärmfeste Stähle, Katalysator zur Synthese von Schwefelsäure (Vanadium-V-Oxid)
- Wolfram: Glühlampen (höchster Schmelzpunkt aller Metalle), Spezialstähle
- Zink: Legierungsbestandteil (Messing), Zinkdruckgussteile (Zamak-Legierung), Verzinkung von Stahlteilen (Feuerverzinken, Bandverzinken..)
- Zinn: Legierungsbestandteil (Bronze), Lote (Lötzinn), Weißblech, Zinnfiguren
- Zirconium: Lambdasonde im Auto (Messung des Sauerstoffgehalts im Abgas)
- Karl Otto Henseling: Bronze, Eisen, Stahl. Die Bedeutung der Metalle in der Geschichte.. In: Kulturgeschichte der Naturwissenschaften und der Technik. Rowohlt 1981, Reinbek 1981, ISBN 3499177064.
- Metallurgie
- Metallgitter – Metallbindung
- Halbmetall – Nichtmetall
- Periodensystem
- Festkörper
- Ikora, Verfahren zur farblichen Veränderung zwecks Dekoration
- Animationen der Atome von Metallen und Nichtmetallen: http://www.physik.rwth-aachen.de/~harm/aixphysik/atom/Periodic/index.html
- Werkstofftechnik-Skripte - Metalle
- ↑ Uwe Kreibig: Wann ist Gold ein Metall?. In: Physik Journal. 1, Nr. 1, 2002, S. 20-21.
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics: 87th Edition: 2006 - 2007. 87. Auflage. B&T, 2006, ISBN 0849304873.
Metalle bilden diejenigen chemische Elemente, die sich im Periodensystem der Elemente links und unterhalb einer Trennungslinie von Bor bis Astat befinden. Das sind etwa 80 Prozent der chemischen Elemente, wobei der Übergang zu den Nichtmetallen über die Halbmetalle fließend ist. Häufig wird der Begriff auch für Legierungen, intermetallische Phasen und die metallischen Modifikationen von Nicht- oder Halbmetallen verwendet, wenn diese in fester oder flüssigen Form die folgenden vier charakteristischen metallischen Stoffeigenschaften aufweisen:
Alle diese Eigenschaften beruhen darauf, dass der Zusammenhalt der betreffenden Atome mit der metallischen Bindung erfolgt, deren wichtigstes Merkmal die im Gitter frei beweglichen Elektronen sind.
Ein einzelnes Atom dieser Elemente hat keine metallischen Eigenschaften; es ist kein Metall. Erst wenn mehrere solcher Atome miteinander wechselwirken und zwischen ihnen eine metallische Bindung besteht, zeigen solche Atomgruppen (engl. cluster) metallische Eigenschaften. [1]
Atome dieser Elemente können sich bei extrem schneller Abkühlung auch amorph zusammenlagern, ohne ein Kristallgitter zu bilden - siehe Metallisches Glas.
Andererseits können auch Atome anderer Elemente unter extremen Bedingungen (Druck) metallische Bindungen eingehen und somit die genannten metallischen Eigenschaften annehmen - siehe metallischer Wasserstoff.
Metalle finden seit Beginn der Zivilisation vielfältige Anwendungen als Werkstoffe. Unter dem Begriff Metallphysik oder auch Metallkunde beschäftigen sich Physiker und Materialwissenschaftler mit allen Grundlagen, siehe unter Festkörperphysik, und mit Anwendungen, siehe unter Materialwissenschaft.
Inhaltsverzeichnis |
Einteilung
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Traditionell unterteilt man Metalle nach der Dichte in Schwermetalle und Leichtmetalle und nach der Reaktivität in Edelmetalle und unedle Metalle, wobei Letztere gute Reduktionsmittel darstellen. Siehe hierzu auch den Hauptartikel Metallischer Werkstoff (sowie zur Reaktivität unter Redoxreaktion).
Im Periodensystem der Elemente sind Metalle im Bereich links und unterhalb einer Linie vom Bor zum Astat (s. o.), wobei der metallische Charakter von oben nach unten bzw. von rechts nach links zunimmt. Ganz oben rechts befinden sich die Nichtmetalle, dazwischen die Halbmetalle. Die Nebengruppenelemente sind ausnahmslos Metalle.
Für das chemische Verhalten ist auch die Zugehörigkeit zu Haupt- oder Nebengruppen des Periodensystems entscheidend.
Siehe auch: Refraktärmetalle
Physikalische Eigenschaften
Allgemeines
Metallatome sind durch folgende Eigenschaften gekennzeichnet:
Daraus resultiert, dass Metallatome sich untereinander nicht wie viele Nichtmetalle über Atombindungen zu Molekülen oder Gittern verbinden können. Allenfalls in Metalldämpfen kommen solche Atombindungen vor, z. B. besteht Natriumdampf zu etwa 1 % aus Na2-Molekülen.
Metalle ordnen sich vielmehr zu einem Metallgitter aus positiv geladenen Atomrümpfen, während die Valenzelektronen über das ganze Gitter verteilt sind. Keines dieser Elektronen gehört mehr zu einem bestimmten Kern, diese Elektronen sind frei beweglich, also nicht an bestimmte Energieniveaus (Orbitale) gebunden, sie befinden sich im „Leitungsband“ und bilden ein „Elektronengas“. Eine exaktere Betrachtung unter Berücksichtigung des Orbitalmodells liefert das Bändermodell.
Aus dieser Bindungsart und diesem Gitteraufbau resultieren folgende typische Eigenschaften der Metalle:
Schmelz- und Siedetemperaturen
Als hochschmelzend bezeichnet man Metalle, deren Schmelzpunkt TE über 2000 K bzw. über dem Schmelzpunkt von Platin (TE-Platin = 2045 K = 1772 °C) liegt. Dazu gehören die Edelmetalle Ruthenium, Rhodium, Osmium und Iridium und Metalle der Gruppen IVA (Zirconium, Hafnium), VA (Vanadium, Niob, Tantal), VIA (Chrom, Molybdän, Wolfram) und VIIA (Technetium, Rhenium).
Wärmeleiteigenschaften
Die für die Wärmeleitung relevanten Eigenschaften wie Dichte, Wärmekapazität, Wärmeleitfähigkeit und Temperaturleitfähigkeit variieren stark. So hat etwa Silber mit 427 W/(m·K) eine ca. 20-fach höhere Wärmeleitfähigkeit als Mangan, siehe Liste mit Werten.
Legierungen
Die Verbindungen oder auch Lösungen von verschiedenen Metallen miteinander oder ineinander heißen Legierungen. Diese haben oft völlig andere physikalische und chemische Eigenschaften als die reinen Metalle. Vor allem die Härte ist teilweise um Größenordnungen höher. Ebenso ist vielfach die Korrosionsbeständigkeit deutlich erhöht. Der Schmelzpunkt von Legierungen liegt dagegen unter dem der reinen Metalle; bei einer bestimmten Zusammensetzung wird der tiefste Schmelzpunkt erreicht, das Eutektikum.
Reine Metalle werden praktisch nicht verwendet, außer bei der Herstellung elektrischer Leitungen, da reine Metalle die größte Leitfähigkeit besitzen. Hier werden unlegierte Metalle verwendet, vor allem Kupfer und Aluminium.
Chemische Eigenschaften
In Verbindung mit Nichtmetallen treten die Metalle im Allgemeinen als Kationen auf, d. h. die äußeren Elektronen werden vollständig an die Nichtmetallatome abgegeben und es bildet sich eine Ionenverbindung (Salz). In einem Ionengitter werden die Ionen nur durch elektrostatische Kräfte zusammengehalten.
Bei Verbindungen mit Übergangsmetallen und bei größeren Anionen (wie dem Sulfid-Ion) können alle Übergangsstufen zur Atombindung vorkommen.
Mit Nichtmetallen wie Wasserstoff, Kohlenstoff und Stickstoff werden auch Einlagerungsverbindungen gebildet, wobei sich die Nichtmetallatome in Lücken des Metallgitters befinden, ohne dieses wesentlich zu verändern. Diese Einlagerungsverbindungen behalten die typischen Metalleigenschaften wie die Elektrische Leitfähigkeit.
Metallkationen, v. a. die der Nebengruppenmetalle, bilden mit Basen (Wasser, Ammoniak, Halogeniden, Cyaniden u. v. a.) Komplexverbindungen, deren Stabilität nicht allein durch die elektrostatische Anziehung erklärt werden kann.
Metalle in höheren Oxidationsstufen bilden auch Komplexanionen, z. B.:
Vorkommen
Der Erdkern besteht zum größten Teil aus Eisen, da es das kernphysikalisch stabilste Element ist.
In der Erdkruste dagegen überwiegen die Nichtmetalle, relativ häufige Metalle sind Aluminium, Eisen, Mangan, Titan, Calcium, Magnesium, Natrium und Kalium. Viele seltene Metalle treten aber in ihren Abbaustätten stark angereichert auf. Gesteine, die klassische Werkmetalle in abbauwürdigen Konzentrationen enthalten, werden Erze genannt. Zu den wichtigsten Erzen gehören:
Andere Metallverbindungen wie Kochsalz oder Kalk werden dagegen nicht als Erze bezeichnet.
Manche Edelmetalle, v. a. Gold, kommen auch gediegen, d. h. in reiner Form und nicht als Verbindung (Erz oder Mineral) vor.
Verwendung
Viele Metalle sind wichtige Werkstoffe. Unsere moderne Welt wäre ohne Metalle unmöglich. Nicht ohne Grund werden Phasen der Menschheitsentwicklung nach den verwendeten Werkstoffen als Steinzeit, Bronzezeit, Eisenzeit bezeichnet.
Die folgende Liste enthält die wichtigsten Metalle und Legierungsbestandteile, keine Verbindungen.
Metall als zivilisatorisches Entwicklungsmerkmal
Anhand der Nutzungs- und Verarbeitungsweisen von Metallen werden wichtige Epochen der Menschheitsgeschichte unterschieden.
Im Allgemeinen sind dies:
Metalle in der Astronomie
In der Astronomie bezeichnet Metall jedes chemische Element mit einer Ordnungszahl höher als Helium, siehe Metallizität. Diese Unterscheidung ist sinnvoll, da Wasserstoff und Helium zusammen mit einigen Spuren von Lithium die einzigen Elemente sind, welche im Universum durch den Urknall entstanden sind. Alle weiteren Elemente entstanden später, zum Beispiel in Sternen durch Kernfusion oder durch Supernovae. Die Metallizität von Objekten des Weltraums kann daher als Indikator für seine stellare Aktivität aufgefasst werden.
Es wird außerdem angenommen, dass Wasserstoff im Inneren von hinreichend schweren Gasplaneten in den metallischen Zustand übergehen kann. Dieser metallische Wasserstoff ist wahrscheinlich auch für das extrem starke Magnetfeld des Jupiter verantwortlich.
Metall in der Chinesischen Philosophie
Metall bezeichnet ein Element der traditionellen Fünf-Elemente-Lehre.
Heraldik
Als Metalle werden in der Heraldik die Tinkturen (Wappenfarben) Gold und Silber bezeichnet. Bei Wappenmalereien wird als Ersatz für Gold die Farbe Gelb und als Ersatz für Silber die Farbe Weiß verwendet.
Literatur
Siehe auch
Weblinks
Einzelnachweise
Alkalimetalle | Erdalkalimetalle | Halogene | Edelgase Lanthanoide | Actinoide | Übergangsmetalle | Metalle | Halbmetalle | Nichtmetalle
Wikimedia Foundation.