- Molare Reaktionsenthalpie
-
Die Reaktionsenthalpie ΔHR gibt die Änderung der Enthalpie im Verlauf einer Reaktion an, also den Energieumsatz einer bei konstantem Druck durchgeführten Reaktion. Hierbei ist egal, auf welchem Weg die Reaktion stattfindet oder in welcher Form (Wärme, Arbeit) Energie während der Reaktion aufgenommen oder abgegeben wird (Hess'scher Wärmesatz). Die Reaktionsenthalpie ist immer die Differenz der Enthalpien der Produkte und der Edukte.
Da Stoffe je nach Temperatur und Druck verschiedene Energien haben (zum Verständnis: Ein Gas hat unter hohem Druck mehr Energie gespeichert als unter niedrigem Druck), können Energiebilanzen verschiedener Reaktionen nur dann direkt miteinander verglichen werden, wenn man sich auf gleiche Außenbedingungen bezieht. Dazu verwendet man meist Standardbedingungen, seltener Normalbedingungen. Die Reaktionsenthalpie unter Standardbedingungen heißt Standardreaktionsenthalpie ΔHR°.
In der Chemie wird meistens die molare Reaktionsenthalpie verwendet, bei der die Reaktionsenthalpie auf die Stoffmenge von einem Mol bezogen wird. Die Einheit dieser ist dementsprechend [kJ/mol].
Exotherm, Endotherm
Da die Energiebilanz für das System angegeben wird, ist ΔH negativ, wenn das Produkt energetisch tiefer als das Edukt liegt und somit insgesamt Energie abgegeben wird. Wandelt man die freiwerdende Energie nicht um, wird Wärme freigesetzt und die Probe erwärmt sich. Die Reaktion ist also exotherm.
Muss jedoch Energie aufgenommen werden, da das Produkt eine höhere Energie als das Edukt hat, wird ΔH positiv. Die nötige Energie wird häufig aus der Umgebungswärme entnommen, die Umgebung wird kälter. Prozesse, bei denen Wärme aufgenommen wird, heißen endotherm.
Ob ΔH positiv oder negativ ist, kann man auch ohne Tabellenwerte berechnen, indem man die Anzahl der Polaren Bindungen des Eduktes von der Anzahl der polaren Bindungen des Produktes subtrahiert.
Temperaturabhängigkeit
Die Reaktionsenthalpie ist so wie die Enthalpie temperaturabhängig. Wenn sich die Temperatur eines Stoffes ändert, so hat dies auch Auswirkungen auf seine Enthalpie. Unter der Voraussetzung, dass es im betrachteten Temperaturintervall zu keinem Phasenübergang kommt, ergibt sich die Enthalpie bei T2 wie folgt:
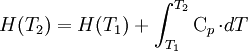
Die Wärmekapazität Cp kann näherungsweise vor das Integral gezogen werden, wenn sie innerhalb des gewählten Temperaturbereichs (von T1 nach T2) ungefähr konstant bleibt.
Wenn nun eine Reaktion betrachtet wird, ergibt sich für Reaktionsenthalpie:
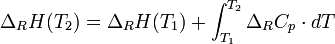
Diese Gleichung wird auch Kirchhoffsches Gesetz genannt.
ΔRCp ergibt sich aus den molaren Wärmekapazitäten der an der Reaktion beteiligten Stoffe und den dazugehörige stöchiometrischen Faktoren.
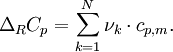
Verwandte Größen
Bei konstantem Druck:
- Enthalpie
- Gibbs-Energie (freie Enthalpie)
- Chemisches Potential
Bei konstantem Volumen:
Wikimedia Foundation.
