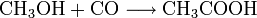- Monsantoprozess
-
Der Monsanto-Prozess ist ein wichtiges Verfahren zur industriellen Darstellung von Essigsäure. Der Prozess findet bei einem Druck von 30-60 bar und einer Temperatur von 150-200°C statt mit einer Selektivität von über 99 %. Dabei wird Methanol mit Kohlenmonoxid katalytisch zu Essigsäure umgesetzt. Die Summengleichung lautet:
Der Monsanto-Prozess wurde mittlerweile durch den Cativa-Prozess ergänzt, der bei ähnlichem Reaktionsmechanismus einen Iridiumkatalysator verwendet und der von der BP entwickelt wurde. Eine weitere Möglichkeit der Darstellung von Essigsäure bietet der Tennessee-Eastman-Prozess, unter Bildung von Essigsäureanhydrid.
Katalytischer Zyklus
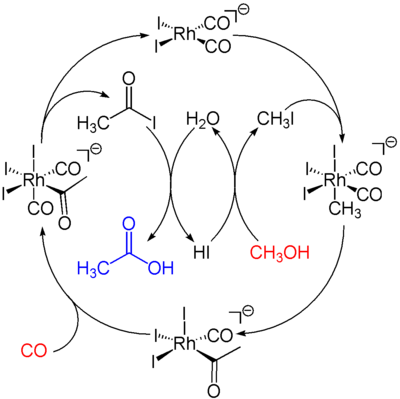
Die katalytisch aktive Spezies ist der anionische Komplex cis-[Rh(CO)2I2]- (1). Der katalytische Zyklus besteht aus sechs Schritten, von denen zwei nicht unter Beteiligung des Rhodiums ablaufen: die Konvertierung des Methanols in Methyliodid und die Hydrolyse des Acetyliodids in Essigsäure. Der erste Schritt ist die oxidative Addition des Methyliodids an den Rhodiumkomplex unter Bildung des Komplexes [(CH3)Rh(CO)2I3]- (2). Dieser Komplex lagert sich schnell in unter Insertion des Carbonyls in die Metall-Methylbindung unter Bildung des Acetylkomplexes [(CH3CO)Rh(CO)I3]- (3). An diesen fünffach-koordinierten Komplex lagert sich ein weiteres Kohlenmonoxid-Molekül an. Dieser Komplex zerfällt unter reduktiver Eliminierung des Acetyliodids CH3COI, welches unter Hydrolyse in Essigsäure und HI zerfällt und der Bildung der Ausgangsverbindung. Die Reaktion ist erster Ordnung bezüglich des Katalysators und des Methyliodids. Daher wird angenommen, dass der geschwindigkeitsbestimmende Schritt die Oxidation des Methyliodids an den Katalysator ist.
- Bild 1: katalytischer Zyklus des Monsanto-Prozesses
Im Cativa-Prozess [1][2] ist der Iridium-Komplex [Ir(CO)2I2]− die katalytisch aktive Spezies. Iridium ist einerseits ein billigeres Katalysatormetall, der Prozess erfordert auch weniger Wasser in der Reaktionslösung und erspart damit Trocknungsstufen in späteren Prozess-Schritten.
Tennessee Eastman Essigsäureanhydrid-Prozess
Die Bildung des Essigsäureanhydrids erfolgt durch die Carbonylierung von Methylacetat in einem Prozess, der sich an den Monsanto-Prozess anlehnt[3]
- CH3CO2CH3 + CO → (CH3CO)2O
Als Katalysatoren werden Rhodiumiodid und Lithiumsalze verwendet. Im Gegensatz zu den obigen Verfahren wird dieses Verfahren wegen der Empfindlichkeit des Anhydrids unter Ausschluss von Wasser durchgeführt.
Quellen
- ↑ Jones J.H.: The CativaTM Process for the Manufacture of Acetic Acid. In: Platinum Metals Review. 44, Nr. 3, 2002, S. 94–105
- ↑
- Sunley G.J., Watson D.J.: High productivity methanol carbonylation catalysis using iridium - The CativaTM process for the manufacture of acetic acid. In: Catalysis Today. 58, Nr. 4, 2000, S. 293–307. doi:10.1016/S0920-5861(00)00263-7
- ↑ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. "Eastman Chemical Company Acetic Anhydride Process" Catalysis Today 1992, 13, S. 73–91. doi:10.1016/0920-5861(92)80188-S
Wikimedia Foundation.