- N2O5
-
Strukturformel 
Allgemeines Name Distickstoffpentoxid Andere Namen DNPO
Summenformel N2O5 CAS-Nummer 10102-03-1 Kurzbeschreibung farblose Kristalle Eigenschaften Molare Masse 108,01 g·mol−1 Aggregatzustand fest
Löslichkeit setzt sich mit Wasser zu Salpetersäure um
Sicherheitshinweise Gefahrstoffkennzeichnung 
unbekannt R- und S-Sätze R: ? S: ? Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Distickstoffpentoxid ist das Anhydrid der Salpetersäure und kann aus dieser durch Entwässern mit Phosphorpentoxid gewonnen werden.[1]
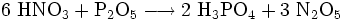
- Salpetersäure reagiert mit Diphosphorpentaoxid zu Phosphorsäure und Distickstoffpentaoxid.
Andere Möglichkeiten der Herstellung bestehen in der Umsetzung von salzartigen Nitraten oder konz. Salpetersäure mit Nitrylfluorid (NO2F) oder von letzterer mit Fluorwasserstoff.
Distickstoffpentoxid sind farblose Kristalle, welche bei 32 °C sublimieren, mit Wasser Salpetersäure bilden und sich bei Raumtemperatur zu NO2 und O2 zersetzen. Im festen Aggregatzustand besitzt Distickstoffpentoxid die Ionenstruktur [NO2+][NO3−]
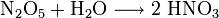
- Distickstoffpentoxid reagiert mit Wasser zu Salpetersäure.
Distickstoffpentoxid ist sehr unbeständig und zerfällt bei schnellem Erhitzen oft explosionsartig unter Abgabe von Sauerstoff.
Es hat sehr stark oxidierende Eigenschaften.
Literatur
- Erwin Riedel: Anorganische Chemie. 5. Auflage. De Gruyter, Berlin 2002, ISBN 3-11-017439-1.
Einzelnachweise
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 489-90.
Wikimedia Foundation.

