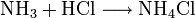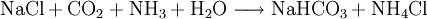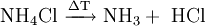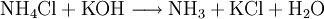- NH4CI
-
Strukturformel 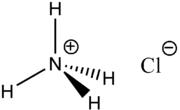
Allgemeines Name Ammoniumchlorid Andere Namen - Ammoniummuriat
- Ammoniaksalz
- Lötstein
- Salmiak
- E 510
Summenformel NH4Cl CAS-Nummer 12125-02-9 PubChem 25517 Kurzbeschreibung farblose Kristalle Eigenschaften Molare Masse 53,49 g·mol−1 Aggregatzustand fest
Dichte 1,526 g·cm−3[1]
Schmelzpunkt Siedepunkt Zersetzung
Dampfdruck Löslichkeit gut in Wasser (372 g/L bei 20°C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36 S: (2)-22 LD50 1650mg/kg (Ratte, oral) [3]
Thermodynamische Eigenschaften ΔHf0 −314,6 kJ·mol−1[4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ammoniumchlorid ist das Ammoniumsalz der Salzsäure. Es ist ein farbloser, kristalliner Feststoff mit der chemischen Formel NH4Cl.
Inhaltsverzeichnis
Vorkommen
Natürlich vorkommendes Ammoniumchlorid ist als Mineral Salmiak bekannt und verbreitet. Der Name Salmiak leitet sich von lat. "sal ammoniacum" (Salz des Ammon, siehe auch Namensherkunft von Ammoniak) ab, da es in der Antike in der Nähe eines Ammon-Tempels im heutigen Ägypten vorkam und mit Halit (Steinsalz) verwechselt wurde.
Gewinnung und Darstellung
Ammoniumchlorid kann durch Neutralisation von wässriger Ammoniaklösung mit Salzsäure oder durch die Reaktion von gasförmigem Ammoniak mit gasförmigen Chlorwasserstoff gewonnen werden.
Ammoniumchlorid fällt als Nebenprodukt bei der Gewinnung von Soda nach dem Solvay-Verfahren an.
Eigenschaften
Ammoniumchlorid ist ein farbloses, gut wasserlösliches Salz, welches kubische Kristalle bildet. Wässrige Lösungen reagieren sauer. Der pH-Wert einer 1%igen Lösung beträgt etwa 5,5. Es ist schlecht in Ethanol löslich und unlöslich in Aceton und Ether. Mit steigender Temperatur dissoziiert Ammoniumchlorid zunehmend zu Ammoniak und Chlorwasserstoff.
Bei 340 °C scheint der Stoff vollständig zu sublimieren, dissoziiert jedoch in die beiden Gase Chlorwasserstoff und Ammoniak. Da es sich hierbei um eine chemische Reaktion handelt, kann man nicht von einer Sublimation sprechen. Unter Druck (34,4 bar) schmilzt Ammoniumchlorid bei 520° C. Beim Versetzen von Ammoniumchlorid mit starken Basen wird gasförmiges Ammoniak freigesetzt.
Verwendung
Verwendung findet Ammoniumchlorid heute unter anderem zur Herstellung von Kältemischungen, in der Färberei und Gerberei. Ebenfalls findet es Anwendung beim Verzinnen, Verzinken oder Löten, da es die Fähigkeit besitzt, mit Metalloxiden flüchtige Chloride zu bilden und somit die Metalloberfläche zu reinigen. Des Weiteren dient es in der Medizin als Expektorans und wird als Elektrolyt in Zink-Kohle-Batterien eingesetzt. Außerdem ist es in Salmiak-Lakritz (Salmiakpastillen) enthalten. Es ist auch häufig in Rauchpulver (weiß) vorhanden. Als Lebensmittelzusatzstoff trägt es die Nummer E 510. Ammoniumchlorid verwendet man in Verbindung mit Ammoniumhydroxid auch als Puffer.
Quellen
- ↑ a b c d Eintrag zu CAS-Nr. 12125-02-9 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 15.08.2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 12125-02-9 im European chemical Substances Information System ESIS
- ↑ Ammonium chloride bei ChemIDplus
- ↑ PAETEC Formelsammlung Ausgabe 2003, Seite 116
Literatur
- Pradyot Patnaik: Handbook of Inorganic Chemicals. McGraw-Hill, New York 2002 ISBN 0-07-049439-8 (Englisch)
- Julius Ruska: Sal ammoniacus, nusâdir und Salmiak, Sitzungsberichte der Heidelberger Akademie der Wissenschaften: phil.-historische Klasse, 14 (1923), 5, S. 3-23
Wikimedia Foundation.