- NNOS
-
NO-Synthase —
Größe 1200-1400 Aminosäuren Struktur Homodimer Kofaktor Häm, FAD, FMN, Tetrahydrobiopterin Bezeichner Gen-Name(n) NOS1, NOS2, NOS3 Enzymklassifikation EC, Kategorie 1.14.13.39 Dioxygenase Reaktionsart Oxidation Substrat L-Arginin + n NADPH + m O2 Produkte Zitrullin + NO + n NADP+ Vorkommen Übergeordnetes Taxon Lebewesen Ausnahmen Archaeen Das Enzym NO-Synthase, kurz NOS, katalysiert die Bildung von Stickstoffmonoxid NO aus der Aminosäure L-Arginin. Es kommt in den meisten Eukaryoten, aber auch in manchen Bakterien vor. NO hat im Organismus in Abhängigkeit von Zielstruktur und Konzentration eine Vielzahl von physiologischen Aufgaben, aber nur eine Halbwertszeit von fünf Sekunden, weswegen es ständig neu hergestellt werden muss. Beim Menschen sind drei Isoformen der NO-Synthase bekannt, die von unterschiedlichen Genen codiert werden. Mutationen in einem dieser Gene (NOS1) können Pylorusstenose Typ 1 (IHPS1) zur Folge haben.[1]
Inhaltsverzeichnis
Isoformen
Man unterscheidet drei Isoformen der NOS:
- eNOS, NOS3, NOS-III: endotheliale NO-Synthase, die aber auch in nicht-endothelialen Zellen vorkommt.
- nNOS, NOS1, NOS-I: neuronale NO-Synthase (z.B. in NANC-Neuronen, wo NO als Neurotransmitter wirkt), aber auch in nicht-neuronalen Zellen vorkommt (und auch z.T. induzierbar ist -> Corpus pineale der Ratte).
- iNOS, NOS2, NOS-II: induzierbare NO-Synthase (z.B. Makrophagen, Mesangialzellen, Kardiomyozyten und glatten Muskelzellen), die aber auch konstitutiv exprimiert wird.
Expression
eNOS und nNOS sind im menschlichen Körper konstitutiv exprimiert (ständig vorhanden), weshalb sie manchmal (veraltet) auch gemeinsam als cNOS (constitutive NOS) bezeichnet werden - im Gegensatz nur iNOS die zwar auch konstitutiv, insbesondere jedoch nach Aktivierung durch Transkriptionsfaktoren vermehrt exprimiert wird.
Durch Bakteriengifte (Endotoxine) oder proinflammatorische Cytokine wird die iNos induziert. Die bekanntesten Induktoren der iNOS in Makrophagen sind IFN-γ, Tumornekrosefaktor-α, Interleukin 1β sowie bakterielle Lipopolysaccharide.
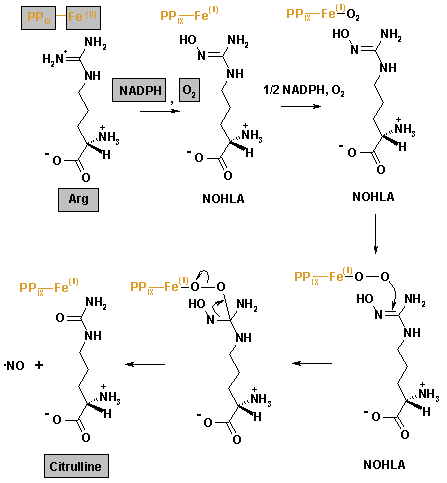
Katalysierte Reaktion
(Abb. 1) Es handelt sich um die Fünf-Elektronen-Oxidation eines der Guanidino-Stickstoffatome von L-Arginin, die in zwei Schritten mit dem Intermediat NOHLA abläuft.[2]
Bei der Reaktion wird L-Citrullin abgespalten, so dass man diese Reaktion auch als Kurzschluss des Harnstoffzyklus – unter Umgehung der Intermediate Ornithin und Argininosuccinat – betrachten kann.
Regulation der Aktivität
eNOS und nNOS
Da beide mischfunktionellen Oxidasen ständig im Organismus vorhanden sind, muss ihre Aktivität einem strengen Regulationsmechanismus unterliegen. Es konnte jedoch beim Corpus pineale der Ratte gezeigt werden, dass die nNOS durchaus auch induzierbar ist. Bei Ratten deren zirkadiane Rhythmik durch Dauerlicht gestört wurde war ein fast vollständiges Verschwinden der nNOS in den Zellen des Corpus pineale zu beobachten. Hier bleibt zu vermuten, dass der Organismus der Ratte die Produktion eines für die Regulation nicht mehr nötigen Moleküls abschaltet, anstatt dessen Aktivität herab zu setzen.
eNOS:
Die Aktivität der eNOS im Gefäßendothel ist zwar auch von mechanischen Kräften (Schubspannung) abhängig, überragende Bedeutung hat jedoch die Regulation über die intrazelluläre Calciumkonzentration. Die aktive Form der eNOS besteht aus einem heterogenen Tetramer aus zwei Molekülen der eNOS und zwei Ca2+/Calmodulin-Komplexen. Bei niedriger intrazellulärer Ca2+ Konzentration bildet sich diese aktive Form nicht aus, kann aber alternativ durch Phosphorylierung auch bei Ruhe-Calciumkonzentrationen aktiviert werden.
iNOS
Im Gegensatz dazu ist die Aktivität der iNOS kaum reguliert, sodass es nach Exprimierung zu einer schnellen, starken und langanhaltenden NO Synthese kommt.Die von der iNOS produzierte Menge an NO kann um das 1000-fache höher sein als durch die konstitutive eNOS. In dieser hohen Konzentration wirkt NO zytotoxisch und dient damit z.B. den Makrophagen zur Immunabwehr. Bei einer Sepsis kann dies jedoch problematische Folgen haben, da NO auch eine Rolle bei der Regulation der Gefäßweite spielt.
Eine Hemmung der durch die iNOS vermittelten NO-Synthese kann über die Verfügbarkeit des Substrates L-Arginin erreicht werden, beispielsweise durch Erhöhung der Expression der extrahepatischen Form des kompetetiven Enzyms Arginase, welche L-Arginin zu L-Ornithin und Harnstoff spaltet und durch die Interleukine 4,10 und 13 sowie bakterielle Lipopolysaccharide induziert wird.
Literatur
- Robert F. Schmidt, Florian Lang: Physiologie des Menschen mit Pathophysiologie; Springer Medizin Verlag, Heidelberg, 30. Auflage 2007
- Werner Müller-Esterl: Biochemie – Eine Einführung für Mediziner und Naturwissenschaftler; Elsevier GmbH, München, 1. Auflage 2004
Einzelnachweise
Wikimedia Foundation.