- Na-K-ATPase
-
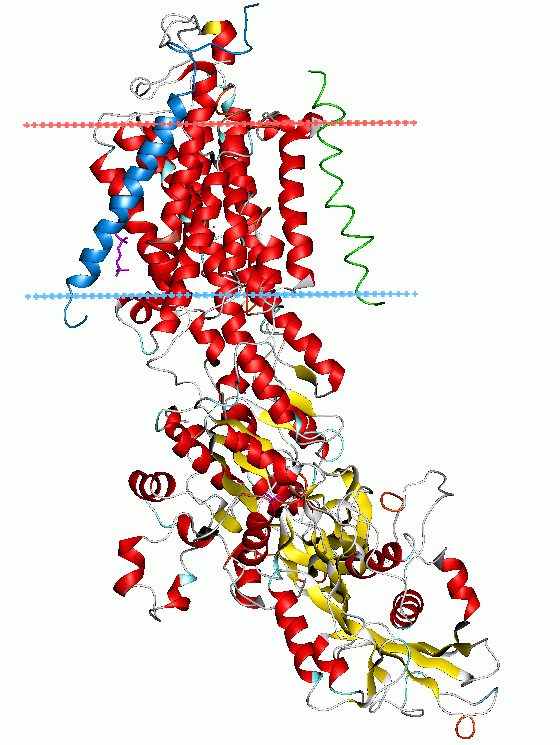
Na+/K+-ATPase Bändermodell der Na+/K+-ATPase nach 3B8E Vorhandene Strukturdaten: 3B8E 1MO7 Größe 1018+303+66 Aminosäuren Struktur α+β+γ, multipass Membranprotein Kofaktor Mg2+ Isoformen α1/2, β1/2, γ1/2 Bezeichner Gen-Name(n) ATP1A1, ATP1A2, ATP1A3, ATP1A4 Transporter-Klassifikation TCDB 3.A.3.1.1 Bezeichnung P-ATPase Enzymklassifikation EC, Kategorie 3.6.3.9 Hydrolase Reaktionsart Hydrolyse Substrat ATP + H2O + 3 Na+innen + 2 K+außen Produkte ADP + Phosphat + 3 Na+außen + 2 K+innen Vorkommen Übergeordnetes Taxon Lebewesen Die Natrium-Kalium-ATPase (genauer: Na+/K+-ATPase), auch als Natrium-Kalium-Ionenpumpe bezeichnet, ist ein in der Zellmembran verankertes Transmembranprotein. Das Enzym katalysiert, unter Hydrolyse von ATP (ATPase), den Transport von Natrium-Ionen aus der Zelle und den Transport von Kalium-Ionen in die Zelle, gegen den Konzentrationsgradienten.
Für Transportprozesse über biologische Membranen, die gegen einen Konzentrationsgradienten erfolgen, muss Energie bereitgestellt werden. Diese wird entweder durch ATP-Hydrolyse oder durch Abbau eines anderen Konzentrationsgradienten erreicht („aktiver Transport“).
Das Phänomen des ATP-getriebenen Transports ist für den Na+/K+ Transport durch die Plasmamembran am besten untersucht. Beide Kationen sind in Zellen ungleich verteilt:
- Die Na+-Konzentration im Inneren der Zelle ist gering (5-15 mmol/l);
- die K+-Konzentration im Inneren ist hoch (120-150 mmol/l).
Dieser lebenswichtige Konzentrationsgradient wird einerseits durch Kalium-Kanäle bewirkt (siehe Blutzucker-Sensorsystem), andererseits durch die elektrogene Natrium-Kalium-ATPase. Diese besteht aus zwei Polypeptiden, d.h. einer α-und einer β-Untereinheit, wobei das α-Element die funktionelle Einheit ist und das β-Element der Verankerung des Proteins in der Zellmembran dient. Die Natrium-Kalium-ATPase kommt in mehreren Isoformen der α-und β-Untereinheiten vor, mit Unterschieden in Verteilung, Affinität zu Herzglykosiden und Funktionen. Der α1-Isoenzymtyp findet sich in allen Zellen des Menschen, α2- und α3-Typen in den Nervenzellen und Herzmuskelzellen (Myokard).
Inhaltsverzeichnis
Geschichte
Die Na+/K+-ATPase wurde 1957 vom dänischen Mediziner Jens Christian Skou entdeckt.[1] 1997 erhielt Skou den Nobelpreis für Chemie „für die Entdeckung des ionentransportierenden Enzyms Natrium-Kalium-ATPase”.[2]
Mechanismus
ATP-Hydrolyse und Na+/K+-Transport sind strikt gekoppelt (elektrogenes Prinzip):
- Je Molekül ATP werden drei Na+-Ionen nach außen und zwei K+-Ionen nach innen befördert. Hierdurch wird das insbesondere für Nerven- und Muskelzellen funktional wichtige elektrische Potential der Zellmembran erhalten.
- für den Pumpmechanismus sind Konformationsänderungen erforderlich, die durch Phosphorylierung eines Aspartat (Asp-) Restes der α-Untereinheit erzeugt werden.
- bei diesem Vorgang werden zunächst drei Na+-Ionen eingeschlossen;
- deren Abgabe nach außen erfolgt im Austausch gegen zwei K+-Ionen, deren Bindung eine Phosphatase aktiviert, die den Asp-Rest wieder dephosphoryliert.
Wirkung der Herzglykoside
- siehe auch Hauptartikel: Herzglykoside
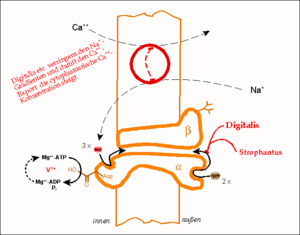 Das Wirkprinzip der Natrium-Kalium-Pumpe (Na+/K+-ATPase). Gezeigt ist eine Funktionseinheit, bestehend aus einer α- und einer β-Kette. Der Phosphorylierungs-Dephosphorylierungszyklus eines Aspartat-Restes, d.h. die treibende Kraft des Pumpvorganges, ist schematisch ausgeführt; dieser Vorgang kann durch Vanadat blockiert und damit nachgewiesen werden. Der im oberen Abschnitt gezeigte Calcium-Transporter (Na+/Ca2+-Antiporter) benutzt die Energie des ATP indirekt, indem er einen bestehenden Na+-Gradienten abbaut. Digitalis-Derivate blockieren die (Na+/K+-ATPase), lähmen damit die gesamte Wirkungskette und lassen den intrazellulären Ca2+-Spiegel ansteigen.
Das Wirkprinzip der Natrium-Kalium-Pumpe (Na+/K+-ATPase). Gezeigt ist eine Funktionseinheit, bestehend aus einer α- und einer β-Kette. Der Phosphorylierungs-Dephosphorylierungszyklus eines Aspartat-Restes, d.h. die treibende Kraft des Pumpvorganges, ist schematisch ausgeführt; dieser Vorgang kann durch Vanadat blockiert und damit nachgewiesen werden. Der im oberen Abschnitt gezeigte Calcium-Transporter (Na+/Ca2+-Antiporter) benutzt die Energie des ATP indirekt, indem er einen bestehenden Na+-Gradienten abbaut. Digitalis-Derivate blockieren die (Na+/K+-ATPase), lähmen damit die gesamte Wirkungskette und lassen den intrazellulären Ca2+-Spiegel ansteigen.Glykoside der Digitalis-Gruppe (Digoxin, Digitoxin und dessen Aglykon Digitoxigenin) und der Gruppe der Strophanthusgewächse (g-Strophanthin (engl. Synonym: Ouabain) und k-Strophanthin) – letztere jedoch nur in hohen Konzentrationen – blockieren die K+-Konformation der ATPase noch im phosphorylierten Zustand. Damit hemmen sie den Ionentransport.
Indirekt steigt hierdurch die Konzentration an intrazellulärem Ca2+ und damit die Kontraktion des Herzmuskels, denn
- der Transport des Ca2+ hängt nach dem Antiport-Prinzip vom Na+-Konzentrationsgradienten ab (Natrium-Calcium-Austauscher).
- Ist dieser verringert, verbleibt Ca2+ in zunehmendem Maße in der Muskelzelle, wobei sich deren Kontraktion verstärkt.
Da die Herzmuskelzellen eines Menschen mit Herzinsuffizienz zuviel Calcium enthalten ("calcium overload", der zur Minderung der Kontraktilität führt), war es bis vor kurzem unverständlich, wieso eine weitere Steigerung des zellulären Calcium-Gehalts zur Steigerung der Kontraktilität führen kann. Eine mögliche erklärende Hypothese: Die α2- und α3-Isoformen der Natrium-Kalium-Pumpen sind zusammen mit den Natrium-Calcium-Austauschern direkt über den Ausläufern des Calcium-Speichers der Zelle (Sarkoplasmatisches Retikulum) lokalisiert. Diese funktionelle Einheit wird Plasmerosom genannt. Hierdurch kann die lokale Natrium- bzw. Calcium-Konzentration durch Hemmung nur relativ weniger Natrium-Kalium-Pumpen durch Herzglykoside gesteigert werden, was das Sarkoplasmatische Retikulum zur Freisetzung von wesentlich größeren Mengen an Calcium an die kontraktilen Proteine (bei z.B. jedem Herzschlag) anregt, ohne daß sich die Gesamt-Konzentration der Zelle an Natrium- und Calcium wesentlich verändert. Diese wird eher durch die α1-Isoform der Natrium-Kalium-Pumpe reguliert. Die Plasmerosome wurden für Nervenzellen und Arterien-Muskelzellen bereits nachgewiesen (Blaustein et al. 2002 und 1998) und sind wahrscheinlich auch in Skelett- und Herzmuskelzellen vorhanden (He et al. 2001, James et al. 1999).
Geringe, d.h. physiologische Konzentrationen von g-Strophanthin, wie sie nach oraler Einnahme (auch nach niedrig dosierter intravenöser Injektion) oder endogen im Körper des Menschen gemessen werden (g-Strophanthin / Ouabain ist ein neuentdecktes Hormon) führen zum Gegenteil des bisher einzig anerkannten Wirkmechanismus, d.h. zur Stimulation der Natrium-Kalium-Pumpe (ca. 50 Studien, z.B. Gao et al. 2002, Saunders & Scheiner-Bobis 2004) mit resultierender Reduzierung des zellulären Natrium- und Calcium-Gehalts. Dies kann zu einem negativ inotropen Effekt wie bei einem Nitro-Präparat (Belz et al. 1984, an Herzgesunden) oder auch zu einem positiv inotropen Effekt (Dohrmann & Schlief-Pflug 1986, an Herzkranken) führen (wahrscheinlich je nach Ausgangslage der Calcium-Konzentration der Herzmuskelzellen).
Auch k-Strophanthin kann die Na-K-Pumpe stimulieren, jedoch nicht Digoxin (Saunders & Scheiner-Bobis 2004). Dies erklärt z.B. die gegensätzliche Wirkung von Strophanthin und Digoxin bei Angina Pectoris, wobei Strophanthin positiv auf EKG und Anfallshäufigkeit wirkt (u.a. Salz & Schneider 1985, Kubicek & Reisner 1973), Digoxin bekanntlich jedoch negativ (u.a. Kubicek & Reisner 1973).
Literatur
- ↑ Skou, J.C. (1957): The influence of some cations on an adenosine triphosphatase from peripheral nerves. In: Biochim. Biophys. Acta. Bd. 23, S. 394-401. PMID 13412736
- ↑ Informationen der Nobelstiftung zur Preisverleihung 1997 an Jens Christian Skou (englisch)
Siehe auch
Weblinks
Gängiges Modell
- Lehrbuch-Darstellung
- Animation der Na-K-Pumpe im Zusammenhang der Zellphysiologie
- Na-K-ATPase und aktiver Transport (eng.)
- Animation: Antiport
- Animation: elektrogene Pumpe (eng.)
- Animation: elektrogene Pumpe (improved, eng.)
Gegenmodelle und Einwände
Wikimedia Foundation.