- Phosgen
-
Strukturformel 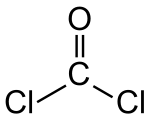
Allgemeines Name Phosgen Andere Namen - Carbonylchlorid
- Kohlensäuredichlorid
- Kohlenoxychlorid
Summenformel CCl2O CAS-Nummer 75-44-5 PubChem 6371 Kurzbeschreibung farbloses Gas
- in hoher Verdünnung süßlicher Geruch
- konzentriert fauliger Obstgeruch[1]
Eigenschaften Molare Masse 98,92 g·mol−1 Aggregatzustand gasförmig[1]
Dichte Schmelzpunkt Siedepunkt 7,44 °C[1]
Dampfdruck Löslichkeit - zersetzt sich in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 


Gefahr
H- und P-Sätze H: 330-314 EUH: keine EUH-Sätze P: 260-280-304+340-303+361+353-305+351+338-315-405-403 [1] EU-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 
Sehr giftig (T+) R- und S-Sätze R: 26-34 S: 9-26-36/37/39-45 MAK 0,1 ml·m−3[1]
LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Phosgen ist der Trivialname für Kohlenoxiddichlorid oder Carbonylchlorid, COCl2, das Dichlorid der Kohlensäure. Als Diphosgen bzw. Triphosgen werden Verbindungen der Zusammensetzung C2O2Cl4 bzw. C3O3Cl6 bezeichnet, die zwar als Syntheseäquivalente des Phosgens eingesetzt werden, jedoch i.e.S. keine Oligomere desselben sind.
Inhaltsverzeichnis
Geschichte
Phosgen wurde 1812 von John Davy, dem jüngeren Bruder von Sir Humphry Davy, entdeckt. Der Name Phosgen (griech.: durch Licht erzeugt; vgl. biogen, anthropogen) stammt von der von ihm durchgeführten photoinduzierten Addition von Chlorgas an Kohlenstoffmonoxid.
Der Einsatz von Phosgen als chemischer Gaskampfstoff (Grünkreuz) war für den Großteil der etwa 90.000[5] Gastoten des Ersten Weltkriegs verantwortlich.
Eigenschaften
Phosgen ist ein sehr giftiges Gas, dessen Geruch als süßlich faul (faulende Bananenschale oder feuchtes Heu) beschrieben werden kann. Dieser ist sehr charakteristisch und schnell zu identifizieren.
Phosgen ist gut in organischen Lösungsmitteln löslich (beispielsweise Benzol, Toluol, Chlorbenzolen und andere), es löst sich in Wasser unter allmählicher Zersetzung zu Kohlenstoffdioxid und Salzsäure, weshalb für die Synthese oder Umsetzung von Phosgen wasserfreie organische Lösungsmittel verwendet werden müssen.

- Hydrolyse von Phosgen zu Kohlenstoffdioxid und Chlorwasserstoff
Phosgen hat eine Verdampfungswärme von 24,38 kJ·mol−1.
Giftigkeit
Da Phosgen schlecht wasserlöslich ist, kann es beim Eindringen in die Lunge bis zur Blut-Luft-Schranke in den Lungenbläschen (Alveolen) gelangen. Geringe Dosen zersetzen sich in der Lunge mit der dort vorhandenen Feuchtigkeit allmählich zu Kohlenstoffdioxid und Salzsäure; die letztere verätzt das Lungengewebe und die Alveolen. Dies führt nach 2-3 Stunden zu quälendem Husten, Zyanose und Lungenödemen und endet meist tödlich. Der Tod tritt in der Regel bei vollem Bewusstsein ein. Hohe Dosen können auch binnen Sekunden oder Minuten zum Tod führen, indem die Phosgenmoleküle in hoher Anzahl mit den Aminosäuren der Alveolenwände reagieren und den Sauerstoffaustausch verhindern. Das in organischen Lösungsmitteln gelöste Phosgen beschleunigt und potenziert die giftige Wirkung. Anders als Senfgas wird Phosgen nur durch die Lunge aufgenommen, nicht durch die Haut.
Unfälle
- Am 20. Mai 1928 trat aus undichten Tanks auf dem Gelände der Hamburger Chemiefabrik Stolzenberg Phosgen aus. Es starben 10 Menschen, etwa 150 wurden verletzt.
- Am 3. Dezember 1984 trat im indischen Bhopal unter anderem Phosgen als Nebenprodukt zu Methylisocyanat aus, was zur bisher schlimmsten Chemiekatastrophe und einer der bekanntesten Umweltkatastrophen der Geschichte führte. Tausende von Menschen starben an ihren unmittelbaren Folgen.
- Am 14. März 2008 kam es in einem Labor der Technischen Universität München in Garching auf Grund eines technischen Defektes dazu, dass sich ein Schlauch von einer Versuchsanlage löste und Phosgen austrat. Zwei Personen wurden auf die Intensivstation gebracht, da sich Lungenödeme gebildet hatten, 38 weitere Personen wurden vorsorglich im Krankenhaus untersucht.[6]
Herstellung
Phosgen wird unter katalytischem Einfluss von Aktivkohle aus Kohlenmonoxid und Chlor hergestellt:
Die stark exotherme Reaktion muss mit großem Aufwand gekühlt werden, da Temperaturen im „Hotspot“ von bis zu 600 °C entstehen. Kohlenmonoxid wird im Überschuss eingesetzt, um die vollständige Umsetzung des Chlors zu garantieren und somit einem Chloreisenbrand vorzubeugen. Restmengen von Methan, die aus der Kohlenmonoxidherstellung stammen, reagieren zu Tetrachlorkohlenstoff. Das Kohlenmonoxid muss unbedingt frei von Wasserstoff sein, damit kein Chlorknallgas entsteht.
Phosgen kann durchaus auch bei der Verbrennung von chlorhaltigen Kunststoffen (beispielsweise PVC) in Gegenwart von Metall und Kohle und bei Verbrennung (z.B. Zulöten alter Kupferleitungen von Kälteanlagen) des seit 1. Januar 2010 verbotenen Kältemittels R22 entstehen. Im Labormaßstab kann es auch aus Tetrachlormethan und rauchender Schwefelsäure („Oleum“) hergestellt werden:
Verwendung
Phosgen wurde als chemischer Gaskampfstoff militärisch eingesetzt.
Phosgen ist ein wichtiger Synthesebaustein beispielsweise zur Herstellung von Carbonsäurechloriden (wobei hier meist das unproblematischere Thionylchlorid verwendet wird) und Polyurethanen (über Isocyanate) sowie Polycarbonat-Kunststoffen (Abkürzung: PC, beispielsweise zur Herstellung von CDs) und anderen Zwischenprodukten, die dann zur Herstellung von Medikamenten, Farbstoffen und Insektiziden dienen.
Wegen der Gefährlichkeit des Phosgens wird es heute in der chemischen Industrie zum überwiegenden Teil innerhalb derselben Anlage erzeugt, in der es auch verbraucht wird, sodass kein Transport stattfinden muss und das entstehende giftige Phosgen möglichst zügig und vollständig zu harmlosen Folgeprodukten umgesetzt wird. Als Alternative stehen Diphosgen (Trichlormethoxyformylchlorid) und Triphosgen (Bis-(Trichlormethylcarbonat)) zur Verfügung, die dieselbe Reaktivität zeigen, jedoch wesentlich ungefährlicher in der Anwendung und einfacher zu lagern sind.
Siehe auch
- Liste chemischer Kampfstoffe
- Chemische Waffe
- Lungenkampfstoff
- Maskenbrecher
- Grünkreuz, Nesselstoff ("Rotkreuz"), Gelbkreuz, Senfgas (Loste), Weißkreuz
- Diphosgen, Triphosgen, Thiophosgen
Einzelnachweise
- ↑ a b c d e f g h i j Eintrag zu Phosgen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Februar 2008 (JavaScript erforderlich).
- ↑ a b Eintrag zu CAS-Nr. 75-44-5 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ TOXNET: Eintrag zu Phosgen in der Hazardous Substances Data Bank (HSDB).
- ↑ ESIS: IUCLID Datenblatt für Phosgen, Stand Februar 2000.
- ↑ Die Atomwaffe des kleinen Mannes. In: Der Spiegel. Nr. 39, 1998 (26. September 1998, online).
- ↑ Versuchpanne - Kampfgas strömt durch Münchner Uni, Spiegel Online, Meldung vom 16. März 2008.
Literatur
- Beyer Hans, Walter Wolfgang: Lehrbuch der Organischen Chemie; S. Hirzel Verlag; Stuttgart - Leipzig 1998, 23. überarb. und aktualisierte Auflage; ISBN 3-7776-0808-4.
- Dominique Lapierre und Javier Moro: Fünf nach zwölf in Bhopal. Die unglaubliche Geschichte der größten Giftgaskatastrophe unserer Zeit. Europa Verlag, Wien 2004 (französische Originalausgabe 2001), ISBN 3-203-79508-6.
Wikimedia Foundation.



