- Standardwasserstoffhalbzelle
-
Der Begriff Wasserstoffelektrode wird allgemein für Elektroden verwendet, an denen Wasserstoffgas H2 entwickelt oder verbraucht wird. Die Wasserstoffelektrode ist ein wichtiges Hilfsmittel für Messungen der Elektrochemie und der Physikalischen Chemie: Sie ist eine der wichtigsten Referenzelektroden, das heißt, sie dient zur Bestimmung des Potentials anderer Elektroden durch eine einfache Spannungsdifferenzmessung. Das Potential ist die wichtigste Größe zur Beschreibung des elektrochemischen Zustands einer Elektrode.
Besonders bedeutsam sind die Normal (NHE)- und die Standardwasserstoffelektrode (SHE), da deren Potential als Nullpunkt der Standardpotentialskala definiert ist. Das Potential von Wasserstoffelektroden wird durch die Reaktion:
beschrieben.
Inhaltsverzeichnis
Standard-Wasserstoffelektrode
Die Standard-Wasserstoffelektrode, auch Standardwasserstoffelektrode (SHE = Standard Hydrogen Electrode) genannt, dient zunächst wie jede Bezugselektrode dem Zweck, ein genau definiertes Potential zu liefern. Darüber hinaus ist sie zur Bestimmung von Standardpotentialen besonders geeignet, da ihr Potential definitionsgemäß der Nullpunkt der Potentialskala ist. Im Gegensatz zur Normalwasserstoffelektrode (NHE = Normal Hydrogen Electrode), bei der mit der Stoffmengenkonzentration gearbeitet wird, wird bei der Standardwasserstoffelektrode mit der Aktivität gearbeitet.
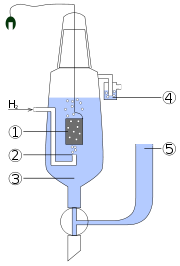
Aufbau und Funktion
Das Potential der Elektrode wird durch die Reaktion:
festgelegt. Für die zuverlässige Potentialmessung ist es wichtig, dass auch tatsächlich eine Reaktion stattfinden kann, d.h. die Hin- und Rückreaktion müssen genügend schnell verlaufen, damit sich ein Gleichgewicht einstellen kann. Daher ist ein Katalysator notwendig, in diesem Fall Platin, das zugleich als Edelmetall eine nicht korrodierende Elektrode bildet.
Die Standard-Wasserstoffelektrode, die den Nullpunkt der Standardpotentialskala festlegt, besteht daher aus einem platinierten (d. h. elektrolytisch mit Platinschwarz überzogenem) Platinblech, welches in eine Säure-Lösung mit einer Ionenaktivität der Protonen H + von a[H + ] = 1 eintaucht. Die Platinelektrode wird von Wasserstoffgas bei einem Druck von 101,3 kPa und einer Temperatur von 298,15 K umspült. Das Wasserstoffgas adsorbiert teilweise am Platin und bildet ein Gleichgewicht mit den Wasserstoffionen, und legt so das elektrochemische Potential fest.
Das elektrische Potential, das sich an dieser Elektrode bildet, ist das Standardpotential, welches als identisch Null definiert wird.
Andere Wasserstoffelektroden
Für manche elektrochemischen Untersuchungen werden auch Wasserstoffelektroden verwendet, die bei Umgebungsdruck betrieben werden; die Wasserstoffelektroden für die Wasserelektrolyse arbeiten oft bei Überdruck. Für Untersuchungen in Säuren oder Laugen benutzt man manchmal auch eine Wasserstoffelektrode in derselben Lösung wie die zu messende Elektrode; auf diese Weise kann man erreichen, dass sich das gemessene Potential nicht mit dem pH-Wert ändert.
Allgemein gilt für Wasserstoffelektroden, an denen die Reaktion:
abläuft, folgende Abhängigkeit des Gleichgewichtspotentials E vom Wasserstoffdruck p[H2] und von der Aktivität a[H3O + ] der Oxoniumionen:
Dabei ist E00 das Standardpotential (dieses ist per definitionem gleich null), R ist die Universelle Gaskonstante, T ist die Temperatur und F ist die Faraday-Konstante .
Bei der Elektrolyse von Wasser treten noch Überspannungen auf, das bedeutet, die benötigte Zellspannung ist aufgrund kinetischer Hemmung höher als die Gleichgewichtsspannung. Die Überspannung steigt mit zunehmender Stromdichte an den Elektroden. Die Messung von Gleichgewichtspotenzialen erfolgt daher möglichst stromlos.
Bedeutung und Handhabung
Aufgrund der Definition, dass Standardpotentiale relativ zur Standard-Wasserstoffelektrode gemessen werden, hat diese natürlich eine enorme Bedeutung für die Physikalische Chemie. Andererseits ist sie sehr umständlich in der Handhabung: Zum einen erfordert sie den Umgang mit Wasserstoffgas, wobei durch geschlossene Gefäße die Knallgasbildung vermieden werden muss. Eine sauerstofffreie Atmosphäre im Elektrolytgefäß ist aber auch nötig, da Sauerstoff das Potential der Elektrode verfälschen kann. Zum anderen ist eine Platinelektrode anfällig für Verunreinigungen, so dürfen keine Fettspuren z.B. von Fingerabdrücken vorhanden sein; um eine hohe katalytische Aktivität zu sichern, sollte sie neu platiniert werden. Für genaue Messungen ist außerdem noch die Druckkontrolle gefordert. Aus diesen Gründen werden Wasserstoffelektroden für Routineuntersuchungen kaum verwendet, ebenso eher selten für Forschungsarbeiten, außer diese zielten darauf ab, Standardpotentiale zu bestimmen. Viel häufiger wurden Kalomel- oder Silber-Silberchlorid-Elektroden (Ag/AgCl) benutzt, bei denen keine gasförmigen Reaktanden auftreten, so dass praktisch keine Druckabhängigkeit auftritt. Heute werden vorwiegend Ag/AgCl-Elektroden eingesetzt, um das giftige Kalomel zu vermeiden. Sie sind im Gegensatz zu Wasserstoffelektroden auch kommerziell in vielen verschiedenen Varianten messfertig erhältlich.
Weiterführende Informationen
Elektrodenpotential, Referenzelektrode, Elektromotorische Kraft, Kathode, Anode, Salzbrücke, Redoxpotential
Wikimedia Foundation.

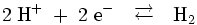
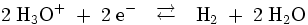
![E = E_{00} + \frac{R\;T}{F} \left( \ln \left( a[\mathrm{H_3 O^+}] \right) - \frac{1}{2}\ln\left( \;p[\mathrm{H_2}] \right) \right)](/pictures/dewiki/101/e4b602e6caf537e97c6224d103802e50.png)