- Trifluorethansäure
-
Strukturformel 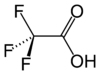
Allgemeines Name Trifluoressigsäure Andere Namen - Trifluorethansäure
- TFA
Summenformel C2HF3O2 CAS-Nummer 76-05-1 Kurzbeschreibung farblose, stechend riechende Flüssigkeit Eigenschaften Molare Masse 114,02 g·mol−1 Aggregatzustand flüssig
Dichte 1,48 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt 72 °C[1]
Dampfdruck Löslichkeit mischbar mit Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Ätzend (C) R- und S-Sätze R: 20-35-52/53 S: (1/2)-9-26-27-28-45-61 WGK 2[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bei der Trifluoressigsäure (Abkürzung: TFA) sind alle drei Wasserstoffatome der Methylgruppe der Essigsäure durch Fluoratome ersetzt (substituiert). Ihre Salze heißen Trifluoracetate.
Inhaltsverzeichnis
Vorkommen
Trifluoressigsäure entsteht in der Umwelt unter anderem durch Photooxidation des häufig verwendeten Kältemittel Tetrafluorethan. Sie ist in der Umwelt praktisch nicht mehr abbaubar (persistent).
Eigenschaften
Trifluoressigsäure ist eine farblose Flüssigkeit mit einem stechendem Essig-Geruch. Sie ist gesundheitsschädlich beim Einatmen, verursacht schwere Verätzungen und ist auch in Verdünnung schädlich für Wasserorganismen. In der Hitze zersetzt sich Trifluoressigsäure unter Bildung von Fluorwasserstoff. Stark exotherme Reaktionen treten mit Metallen (besonders Leichtmetalle) und Laugen auf. Lithiumaluminiumhydrid führt zur Explosion.[3]
Trifluoressigsäure ist eine starke organische Säure. Sie ist mit Wasser, Fluorchlorkohlenwasserstoffen und organischen Lösungsmitteln mischbar. TFA ist stabil bis 400 °C; unter Sauerstoff ist Trifluoressigsäure stabil bis ca. 200 °C.[4] Ihr pKs-Wert beträgt 0,26 (Hudlicky, Chemie der organischen Fluorverbindungen).
Verwendung
Trifluoressigsäure wird in der Biotechnologie als Lösungsmittel für Proteine genutzt.[5] Problematisch ist die weitere Behandlung dieser Lösung. Im größeren Maßstab muss TFA im Hinblick auf Umweltauflagen zurückgewonnen werden (z. B. durch Destillation, Dampfdruck siehe [6]).
Quellen
- ↑ a b c d e f Eintrag zu CAS-Nr. 76-05-1 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 07.01.2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 76-05-1 im European chemical Substances Information System ESIS
- ↑ Sicherheitsdatenblatt (Merck)
- ↑ F. Swarts, Bull. Acad. R. Belg. Classe Sci. 8, 343, 1922
- ↑ J. J. Katz, Nature 174, 509, 1954
- ↑ M. D. Taylor, M. B. Templeman: The Vapor Dissociation of Some Carboxylic Acids. III. Trifluoroacetic Acid and Trifluoroacetic Acid-d, Journal of the American Chemical Society, 78(13), 2950–2953, 1956
Weblinks
Wikimedia Foundation.
