- Trimethylxanthin
-
Strukturformel 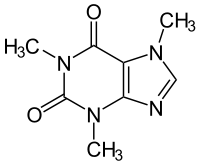
Allgemeines Name Coffein Andere Namen Summenformel C8H10N4O2 CAS-Nummer 58-08-2 PubChem 2519 ATC-Code N06BC01
Kurzbeschreibung farblose, geruchlose, bitter schmeckende Kristalle Eigenschaften Molare Masse 194,19 g·mol–1 Aggregatzustand fest
Dichte 1,23 g·cm–3[1]
Schmelzpunkt Siedepunkt Zersetzung[1]
Dampfdruck Löslichkeit - mäßig in Wasser (20 g·l–1 bei 20 °C[3]) und Alkohol
- gut in Chloroform
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: (2) Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.  Kalottenmodell des Coffeins.
Kalottenmodell des Coffeins.Das Coffein, auch Koffein, ist ein Purin-Alkaloid und ein anregend wirkender Bestandteil von Genussmitteln wie Kaffee, Tee, Cola, Mate, Guaraná, Energy-Drinks und Kakao.
Coffein ist eines der ältesten von Menschen genutzten Stimulanzien. Es ist ein weißes geruchloses, äußerst bitter schmeckendes Pulver und bildet bei der Kristallisierung hexagonale Prismen.
Geschichte
Auf Anregung Goethes untersuchte der Apotheker und Chemiker Friedlieb Ferdinand Runge Kaffeebohnen mit dem Ziel, die wirksame Substanz im Kaffee zu finden. 1820 gelang es Runge erstmals, aus den Kaffeebohnen reines Coffein zu isolieren. Er kann somit als Entdecker des Coffeins angesehen werden. Unabhängig von Runge gelang im Jahre 1821 den französischen Apothekern Pierre Joseph Pelletier, Joseph Bienaimé Caventou und Pierre Robiquet gemeinsam ebenfalls die Isolation des Coffeins. 1832 konnten Christoph Heinrich Pfaff und Justus von Liebig mit Hilfe von Verbrennungsdaten die Summenformel C8H10N4O2 bestimmen. Die chemische Struktur wurde 1875 von Ludwig Medicus als 1,3,7-Trimethylxanthin angenommen. Die vorerst nur angenommene Struktur konnte Hermann Emil Fischer 1895 durch die erste Synthese des Coffeins bestätigen. Der Wirkungsmechanismus wurde erst im 20. Jahrhundert erfolgreich erforscht.
Der in Grüntee und Schwarztee enthaltene Wirkstoff, in der Umgangssprache oft fälschlich als „Teein“ oder „Thein“ bezeichnet, ist ebenfalls „Coffein“.
Eigenschaften
Coffein ist ein Trivialname, der der Substanz wegen des Vorkommens in Kaffee gegeben wurde, der aber nichts über die chemische Zusammensetzung aussagt. Nach der systematischen IUPAC-Nomenklatur lautet die vollständige Bezeichnung 1,3,7-Trimethyl-2,6-purindion, eine Kurzform 1,3,7-Trimethylxanthin – nach der chemischen Ableitung des Coffeins vom Xanthin. Es gehört zur Gruppe der natürlich vorkommenden Purine, genauso wie die strukturähnlichen Dimethylxanthine Theophyllin und Theobromin.
Die Struktur des Coffeins besteht aus einem Doppelring, an dem sich außen mehrere Substituenten befinden. Dieser Doppelring im Kern entspricht der Grundstruktur des Purins. Er besteht aus zwei Ringen, einem 6er- und einem 5er-Ring, die jeweils zwei Stickstoff-Atome enthalten. Außen findet man an C-2 und C-6 jeweils ein doppelt gebundenes Sauerstoff-Atom. Beim Coffein befindet sich an N-1, N-3 und N-7 noch jeweils eine Methylgruppe (-CH3). Daneben gibt es noch das Isocoffein, bei dem eine der Methylgruppen nicht am N-7, sondern am N-9 hängt. Dem Theophyllin fehlt von den drei Methylgruppen die an N-7, dem Theobromin fehlt die an N-1.
Reines Coffein ist unter normalen Bedingungen ein weißes, geruchloses, kristallines Pulver mit bitterem Geschmack. Die Summenformel C8H10N4O2 ergibt eine molare Masse von 194,19 g/mol. Coffein tritt in zwei enantiotrop polymorphen Kristallformen auf. Die bei Raumtemperatur stabile β-Form (Tieftemperaturform) wandelt sich bei 141 °C in die α-Form (Hochtemperaturform) um.[9] Diese schmilzt bei 236 °C.[2] Die Rückumwandlung von α- zur β-Form ist kinetisch gehemmt, so dass die α-Form über Wochen bei Raumtemperatur metastabil sein kann. Die Verbindung ist leicht sublimierbar (ab 178 °C). Die Löslichkeit ist zum Teil stark temperaturabhängig:
Löslichkeit des Coffeins Wasser bei Normaltemperatur: 21,74 g/l Wasser bei 80 °C: 181,82 g/l Ethanol bei Normaltemperatur: 15,15 g/l Ethanol bei 60 °C: 45,45 g/l Aceton: 20,00 g/l Chloroform: 181,82 g/l Coffein bildet bei Kristallisation aus Wasser ein kristallines Hydrat in Form langer Nadeln. Stöchiometrisch enthält das Hydrat im Kristallgitter 0,8 mol Wasser pro Mol Coffein.[10]
Xanthinderivate wie das Coffein werden als schwache Base bezeichnet, da sie Protonen über ihre Stickstoffatome aufnehmen können. Dennoch sind Lösungen von Xanthinderivaten nicht alkalisch. Xanthinderivate werden zu den Alkaloiden gezählt. Als Alkaloide werden generell alle physiologisch wirksamen, niedermolekularen stickstoffhaltigen Verbindungen, insbesondere pflanzlicher Natur, bezeichnet.
Vorkommen
Coffein ist der Hauptwirkstoff des Kaffees. Außer in den Samen des Kaffeestrauchs kommt es auch in über 60 anderen Pflanzen, wie zum Beispiel dem Teestrauch, Guaraná, dem Matebaum und der Kolanuss vor. Die chemisch mit Coffein eng verwandten Wirkstoffe Theophyllin und Theobromin finden sich ebenso in zahlreichen Pflanzenspezies.
Gehalte in Lebens- und Genussmitteln sowie Medikamenten
Produkte mit natürlichem Coffeingehalt:
- Eine Tasse Kaffee (150 ml) enthält etwa 30 bis 100 mg.
- Eine kleine Tasse Espresso (30 ml) etwa 40 mg Coffein.
- Eine Tasse Schwarztee kann je nach Zubereitungsart bis zu 50 mg enthalten. In 100 g trockenen Teeblättern ist mehr Coffein enthalten als in der gleichen Menge gerösteter Kaffeebohnen.
- Guaraná enthält 4 bis 9 g Coffein pro 100 g in der Trockenmasse
- Selbst Kakao enthält mit ungefähr 6 mg pro Tasse ein wenig Coffein, aber hauptsächlich Theobromin.
- In Schokolade findet sich Coffein (Vollmilchschokolade etwa 15 mg/100 g, Bitterschokolade bis zu 90 mg/100 g)[11] neben Theobromin und anderen anregenden Substanzen.
Den folgenden Produkten wird üblicherweise synthetisch erzeugtes Coffein beigemischt. Teilweise wird aber auch natürliches Coffein, gewonnen bei der Kaffee-Entkoffeinierung, verwendet. Besonders sogenannten Wellness-Produkten wird häufig natürliches Coffein als Guaraná-Extrakt zugesetzt.
- Energy-Drinks wie „Red Bull“ (etwa 32 mg/100 ml) und Lipovitan (etwa 50 mg/100 ml).
- „Club-Mate“ (20 mg/100 ml)
- Cola-Getränke (mit 6–25 mg/100 ml) (früher mit natürlichem Coffein aus der Kolanuss) „Coca Cola“ und „Pepsi Cola“: 10 mg/100 ml, „Afri-Cola“, „fritz-kola“ und „Premium-Cola“: 25 mg/100 ml (in Cola sind maximal 25 mg/100 ml zugelassen)
- Kaffee-Bonbons (etwa 80 bis 500 mg Coffein pro 100 g, etwa 3,3 bis 8 mg Coffein pro Bonbon).
- „Aspirin forte“ enthält 50 mg Coffein pro Tablette; normales Aspirin enthält kein Coffein.
- Coffeintabletten enthalten meistens 100 bis 200 mg Coffein
- „Scho-Ka-Kola“ (Energie-Schokolade, Gubor Feinste Schokolade GmbH) enthält 200 mg/100 g natürliches Coffein aus Kakao, Kaffee und Kolanuss-Extrakt.
- Coffein-Natriumsalicylat, ein Salz des Coffeins, das dessen Löslichkeit erhöht, wurde früher als Kreislauf- und Atemstimulans und Diuretikum verwendet.
Hauptwirkungen des Coffeins
Coffein ist weltweit die am häufigsten konsumierte pharmakologisch aktive Substanz. Die Hauptwirkungen des Coffeins sind (siehe auch Coffeinismus):
- Anregung des Zentralnervensystems
- Erhöhung der Herztätigkeit, Pulssteigerung
- Erhöhung des Blutdrucks[12]
- Bronchialerweiterung (Bronchodilatation)
- Hemmung der Rückresorption von Wasser aus dem Primärharn (diuretische Wirkung)
- Anregung der Peristaltik des Darmes
- Verringerung der Blutfließgeschwindigkeit im Gehirn und im Darmbereich.[13]
Coffein hat zwar ein relativ breites Wirkungsspektrum, doch ist es bei geringen Dosen in erster Linie ein Stimulans. Darunter versteht man im Allgemeinen eine Substanz mit erregender Wirkung auf die Psyche, die Antrieb sowie Konzentration steigert und Müdigkeitserscheinungen beseitigt. Dabei wird eine anregende von einer erregenden Wirkung des Coffeins unterschieden, wobei für letztere eine höhere Dosis erforderlich ist. Bei niedriger Dosis tritt fast ausschließlich diese zentral erregende Wirkung des Coffeins hervor, es werden also vor allem psychische Grundfunktionen wie Antrieb und Stimmung beeinflusst. Durch höhere Dosis kommt es auch zu einer Anregung von Atemzentrum und Kreislauf.
Während höhere Coffeinkonzentrationen auch die motorischen Gehirnzentren beeinflussen, wirkt das Coffein in geringeren Konzentrationen hauptsächlich auf die sensorischen Teile der Hirnrinde. Es kommt zu einer Erhöhung des Gehirntonus, d. h. der Spannung der Hirngefäße. Aufmerksamkeit und Konzentrationsvermögen werden dadurch erhöht; die Steigerung von Speicherkapazität und Fixierung (mnestische Funktionen) erleichtert den Lernprozess; mit der Beseitigung von Ermüdungserscheinungen verringert sich das Schlafbedürfnis. Sowohl normaler als auch entkoffeinierter Kaffee erhöhen die Nervenaktivität. Die Stimmung kann sich bis zu leichter Euphorie steigern. In Folge von Assoziationsbahnung verkürzen sich die Reaktionszeiten, was zu einer Beschleunigung des psychischen Tempos führt. Gleichzeitig kommt es zu einer – nur minimalen – Verschlechterung der Geschicklichkeit, speziell bei Aufgaben, die exaktes Timing oder komplizierte visuomotorische Koordination erfordern. Das breite Wirkungsspektrum verdankt Coffein mehreren Wirkungskomponenten, die auf molekularer Ebene in bestimmte Zellvorgänge eingreifen. Das Coffein kann die Blut-Hirn-Schranke fast ungehindert passieren und entfaltet seine anregende Wirkung hauptsächlich im Zentralnervensystem.
Seine Wirkung begründet sich auf zellulärer Ebene wie folgt: Im Wachzustand tauschen Nervenzellen Botenstoffe aus und verbrauchen Energie. Dabei entsteht Adenosin als Nebenprodukt. Eine der Aufgaben des Adenosins besteht darin, das Gehirn vor „Überanstrengung“ zu schützen. Es setzt sich an bestimmte Rezeptoren auf den Nervenbahnen (die Adenosinrezeptoren vom Subtyp A2a). Ist Adenosin gebunden, ist das ein Signal für die Zelle, etwas weniger zu arbeiten. Das ist ein Rückkopplungseffekt: Je aktiver die Nervenzellen, desto mehr Adenosin wird gebildet und desto mehr Rezeptoren werden besetzt. Die Nervenzellen arbeiten langsamer und das Gehirn ist vor „Überanstrengung“ geschützt. Das Coffein ist dem Adenosin in seiner chemischen Struktur ähnlich und besetzt dieselben Rezeptoren, aktiviert sie jedoch nicht. Adenosin kann nicht mehr andocken, und die Nervenbahnen bekommen kein Signal – deshalb arbeiten sie auch bei steigender Adenosinkonzentration weiter. Analgetische, also schmerzhemmende Effekte des Coffeins werden diskutiert. Als Mechanismus werden auch hier die antagonistischen Effekte an den Adenosinrezeptoren und die damit verminderte Wirkung des Adenosins auf das ZNS angenommen. Adenosin wirkt an den sensorischen Nervenendigungen schmerzerzeugend, indem es direkt auf spezifische A2-Rezeptoren einwirkt und eine Hyperalgesie verursacht.[14]
Bei höheren Dosen verhindert Coffein den enzymatischen Abbau von cAMP (cyclischem Adenosin-3’,5’-monophosphat). Dieses spielt im menschlichen Organismus als second Messenger eine wichtige Rolle bei der Hormonregulierung des Zellstoffwechsels. Coffein hemmt jene Enzyme, spezifische Phosphodiesterasen, die für den Abbau von cyclischem zu acyclischem AMP verantwortlich sind. So kommt es durch den gehemmten Abbau zu einem Anstieg der cAMP-Konzentration in den Zellen. Wenn Coffein den Abbau von cAMP einschränkt, hält die von cAMP verursachte Adrenalinausschüttung länger an. Coffein verhindert die dämpfende Wirkung des Adenosin und verlängert die Dauer der Adrenalinwirkung.
Wenn ein Mensch über längere Zeit hohe Dosen Coffein zu sich nimmt, verändern sich die Nervenzellen. Sie reagieren auf das fehlende Adenosin-Signal und bilden mehr Rezeptoren aus, sodass wieder Adenosin-Moleküle an Rezeptoren binden können. Die Nervenzellen arbeiten langsamer. Die anregende Wirkung des Coffeins ist also stark eingeschränkt. Bereits nach 6 bis 15 Tagen starken Coffeinkonsums entwickelt sich eine derartige Toleranz. Wird der Coffeinkonsum stark verringert, können Entzugserscheinungen wie Kopfschmerzen, Übelkeit usw. auftreten, die aber meistens nur von kurzer Dauer sind. Die wissenschaftliche Literatur ist sich nicht darüber einig, ob Coffein wirklich ein Suchtmittel ist, es hat aber einige Gemeinsamkeiten mit typischen Suchtmitteln. Die wichtigsten Eigenschaften, die Coffein mit anderen Suchtstoffen gemeinsam hat, sind Entwicklung von Toleranz, psychische und körperliche Abhängigkeit mit Entzugserscheinungen. Toleranz tritt bei nicht unbedingt übermäßigem, aber regelmäßigem Coffeingenuss auf.
Coffein in Genussmitteln, wie z. B. in Schwarztee oder Schokolade, kann insbesondere für Kinder problematisch sein: so enthalten z. B. drei Dosen Cola und drei Schokoriegel etwa soviel Coffein, wie in zwei Tassen Kaffee enthalten sind (etwa 200 mg Coffein). Ein dreißig Kilogramm schweres Kind kommt somit auf eine Konzentration von 7 Milligramm pro Kilogramm Körpergewicht, eine Dosis, die ausreicht, Nervosität und Schlafstörungen zu verursachen.
Eine günstige Wirkung des Coffeins besteht darin, dass es der alkoholbedingten Entzündung der Bauchspeicheldrüse entgegenwirkt.
Coffein stand auf der Dopingliste des Internationalen Olympischen Komitees, allerdings waren die Grenzwerte so hoch, dass Sportler durchaus Kaffee zum Frühstück trinken konnten. Dennoch wurde am 25. Juli 2000 der spanische Radprofi Óscar Sevilla (Team Kelme) „positiv“ auf Coffein getestet und daraufhin von seinem Verband von der Straßen-Weltmeisterschaft ausgeschlossen. Die World Anti-Doping Agency hat mit Wirkung zum 1. Januar 2004 das Stimulans Coffein von der Liste der verbotenen Substanzen gestrichen.
Die orale LD50 für eine Ratte liegt bei 381 Milligramm pro Kilogramm. Bei Menschen liegt die letale Dosis bei ungefähr 10 Gramm Coffein (5-30 g), was etwa 100 Tassen Kaffee (50-300 Tassen/Tag) entspricht.[15]
Bei Überdosierung (Dosen über 1 g) treten Erregungserscheinungen, stark beschleunigter Puls und Extrasystolien auf[16]; als Gegenmittel können Kohletabletten, Verapamil und Diazepam gegeben werden.
In sehr hoher Konzentration (ab etwa 10 mM im Zellaußenraum) setzt Coffein Calcium2+-Ionen aus dem endoplasmatischen Retikulum frei. Das geschieht durch seine spezifische Bindung an Ryanodin-Rezeptoren. Aufgrund dieser Eigenschaft wird Coffein in der physiologischen Forschung verwendet. Die benötigte Dosis übersteigt die letale Dosis von Säugetieren bei weitem, deshalb wird Coffein nur bei in-vitro-Experimenten eingesetzt.
Wechselwirkungen mit Medikamenten
Coffein verstärkt die herzfrequenzsteigernde Wirkung von Sympathomimetika. Es wirkt beruhigenden Wirkstoffen wie Antihistaminika, Barbituraten entgegen. 50 mg Coffein können eine relative analgetische Wirkungsstärke von 1,3 bis 1,7 bei gleichzeitiger Einnahme von Acetylsalicylsäure oder Paracetamol (mögliche Einsparung von Schmerzmitteln) aufweisen. Disulfiram und Cimetidin reduzieren den Coffeinabbau im Körper. Rauchen sowie Barbiturate beschleunigen den Coffeinabbau im Körper. Die Ausscheidung von Theophyllin wird durch Coffein verringert. Bei gleichzeitiger Einnahme von Antibiotika der Gruppe Gyrasehemmer (Chinolone) ist eine mögliche Verzögerung der Ausscheidung von Coffein und seinem Abbauprodukt Paraxanthin gegeben. Coffein kann eine mögliche Abhängigkeit von Substanzen vom Typ Ephedrin erhöhen.
Vorsichtsmaßnahmen bei der Einnahme
Personen mit Leberzirrhose (mögliche Coffein-Anreicherung), Personen mit Herzarrhythmien, wie Sinustachykardien/Extrasystolen (mögliche Verstärkung), Personen mit Hyperthyreose (mögliche Verstärkung der Nebenwirkungen von Coffein) und Personen mit Angstsyndrom (mögliche Verstärkung) sollten Coffein nur in geringen Dosen (etwa 100 mg/Tag) einnehmen.
Von regelmäßiger Einnahme von hohen Dosen wird wegen des möglichen Auftretens von Coffeinismus abgeraten.
Gewinnung
Coffein kann mittels Extraktion aus Teeblättern oder Kaffeebohnen, zum Beispiel mit einem Soxhlet-Aufsatz, gewonnen werden. Es fällt in großen Mengen bei der Entkoffeinierung von Kaffee an, wobei überkritisches Kohlenstoffdioxid verwendet wird. Industriell wird Coffein hauptsächlich mittels Traube-Synthese hergestellt.
Pharmakokinetik
Der Metabolismus von Coffein ist Spezies-spezifisch. Bei Menschen wird etwa 80 % des aufgenommenen Coffeins durch das Enzym Cytochrom P450 1A2 zu Paraxanthin demethyliert und weitere etwa 16 % werden in der Leber zu Theobromin und Theophyllin umgesetzt. Durch weitere partielle Demethylierung und Oxidation entstehen Urate- und Uracil-Derivate. Aus dem Urin können etwa ein Dutzend unterschiedlicher Coffein-Metaboliten extrahiert werden, aber weniger als 3 % des ursprünglich aufgenommenen Coffeins. Die Hauptausscheidungsprodukte im Urin sind Di- und Monomethylxanthin sowie Mono-, Di- und Trimethylharnsäure.
Die Pharmakokinetik von Coffein hängt von vielen inneren und äußeren Faktoren ab. Die Resorption von Coffein über den Magen-Darm-Trakt in die Blutbahn erfolgt sehr rasch und nahezu vollständig: etwa 45 Minuten nach der Aufnahme ist praktisch das gesamte Coffein aufgenommen und steht dem Stoffwechsel zur Verfügung (Bioverfügbarkeit: 90–100 %). Mit kohlensäurehaltigen Getränken wird Coffein sogar noch rascher aufgenommen. Die maximale Plasmakonzentration wird 15 bis 20 Minuten nach der Aufnahme des Coffeins erreicht. Die Verabreichung von 5–8 mg Coffein/kg Körpergewicht resultiert in einer Plasma-Coffeinkonzentration von 8–10 mg/l. Die biologische Halbwertszeit von Coffein im Plasma beträgt zwischen 2,5 und 4,5 Stunden (andere Quellen sprechen von 3–5 h) bei gesunden Erwachsenen. Dagegen erhöht sich die Halbwertszeit auf im Mittel 80 Stunden (36–144 h) bei Neugeborenen und auf weit über 100 Stunden bei Frühgeburten. Bei Rauchern reduziert sich die Coffein-Halbwertszeit um 30–50 %, während sie sich bei Frauen, die orale Verhütungsmittel einnehmen, verdoppelt. Bei Frauen, die sich im letzten Trimester der Schwangerschaft befinden, steigt sie auf 15 Stunden an. Ferner ist bekannt, dass das Trinken von Grapefruitsaft vor der Coffeinzufuhr die Halbwertszeit des Coffeins verlängert, da der Bitterstoff der Grapefruit die Metabolisierung des Coffeins in der Leber hemmt.
Coffeinol
Nach einer Pilotstudie aus 2003 könnte die Mischung von Ethanol und Coffein auch ein gutes Mittel zur Behandlung von Schlaganfällen sein.[17] Der Mediziner James Grotta von der Universität Texas in Houston spritzte zusammen mit Kollegen insgesamt 23 Patienten die Coffeinol genannte Wirkstoff-Lösung. Diese war gut verträglich, eine klare Aussage zur Wirksamkeit konnte jedoch nicht gemacht werden.
Andere Nutzen
Coffein könnte eventuell gegen Haarausfall eingesetzt werden, wie an der Universität Jena entdeckt wurde.[18] Die heute auf dem Markt erhältlichen Koffein-Shampoos und Tinkturen stehen allerdings im Ruf, voreilige und wissenschaftlich nicht gerechtfertigte Versprechungen zu ihrer Wirksamkeit abzugeben.[19]
Literatur
- Forth, Wolfgang; Adam, Olaf, Coffein: Umgang mit einem Genussmittel, das auch pharmakologische Wirkungen entfalten kann, Deutsches Ärzteblatt 98, Ausgabe 43 vom 26. Oktober 2001, Seite A-2816 / B-2412 / C-2242 ([1])
- Taiwo, Y.O., Levine, J.D.: Direct cutaneous hyperalgesia induced by adenosine. Neurosci 38 (1990) 757-762
Einzelnachweise
- ↑ a b Eintrag zu Coffein in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 26. April 2008 (JavaScript erforderlich)
- ↑ a b Bothe, H.; Cammenga, H.K.: Phase transitions and thermodynamic properties of anhydrous caffeine, J. Thermal Anal. 16 (1979) 267–275.
- ↑ a b Sicherheitsdatenblatt beim Hersteller Merck
- ↑ Eintrag zu CAS-Nr. 58-08-2 im European chemical Substances Information System ESIS
- ↑ Journal of New Drugs. Vol. 5, Pg. 252, 1965.
- ↑ a b c Coffein bei ChemIDplus
- ↑ Veterinary and Human Toxicology. Vol. 39, Pg. 228, 1997.
- ↑ Annals of Emergency Medicine. Vol. 18, Pg. 94, 1989.
- ↑ Epple, M.; Cammenga, H.K.; Sarge, S.M.; Dietrich, R.; Balek, V.: The phase transformation of caffeine: investigation by dynamic X-ray diffraction and emanation thermal analysis, Thermochim. Acta 250 (1995) 29-39.
- ↑ Bothe, H.; Cammenga, H.K.: Composition, properties stability and thermal dehydration of crystalline caffeine hydrate, Thermochim. Acta 40 (1980) 29–39.
- ↑ Inhaltsstoffe von Schokolade.
- ↑ Julien, Robert M.: Drogen und Psychopharmaka, Heidelberg; Berlin; Oxford; Spektrum, Akad. Verl., 1997, Seite 173.
- ↑ Lunt MJ, Ragab S, Birch AA, Schley D, Jenkinson DF: Comparison of caffeine-induced changes in cerebral blood flow and middle cerebral artery blood velocity shows that caffeine reduces middle cerebral artery diameter Physiol Meas. 2004 Apr; 25(2):467–474; PMID 15132312.
- ↑ Taiwo (1990): Direct cutaneous hyperalgesia induced by adenosine. Neurosci 38 (1990) 757–762.
- ↑ Drogen und Psychopharmaka, Robert M. Julien, Titel der Originalausgabe A primer of drug action - a concise and nontechnical guide to the actions, uses, and side effects of psychoactive drugs, Urban & Fischer Verlag (Oktober 2002), ISBN 3-437-21706-2.
- ↑ Brockhaus ABC Chemie, VEB F.A. Brockhausverlag Leipzig 1971.
- ↑ Ethanol Plus Caffeine (Caffeinol) for Treatment of Ischemic Stroke, Stroke 2003; Volltext.
- ↑ Fischer TW, Hipler UC, Elsner P: Effect of caffeine and testosterone on the proliferation of human hair follicles in vitro, in: Int J Dermatol. 2007; 46: 27–35; PMID 17214716.
- ↑ Ökotest-Bericht: Test: Mittel gegen Haarausfall.
Weblinks
- Detaillierte Informationen
- Chemieinfo
- medizin.de: Gesundheitliche Risiken und Nutzen des Coffeins
- Koffein bei Erowid (englisch)
- Koffeinderivate auf Erowid
- Jassal/D'Eustachio/reactome.org: N-atom dealkylation of caffeine
Sicherheitsdatenblätter
Sicherheitsdatenblätter verschiedener Hersteller für Koffein in alphabetischer Reihenfolge (alle PDF):
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.

