- Bariumfluorid
-
Kristallstruktur 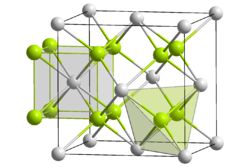
Ba2+: __ F-: __ Allgemeines Name Bariumfluorid Verhältnisformel BaF2 CAS-Nummer 7787-32-8 Kurzbeschreibung farbloser Feststoff
Eigenschaften Molare Masse 175,33 g·mol−1 Aggregatzustand fest
Dichte 4,83 g·cm−3 (20 °C)[1]
Schmelzpunkt 1355 °C [2]
Siedepunkt 2260 °C [1]
Löslichkeit wenig löslich in Wasser: 1,2 g·l−1 (25 °C) [1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 
Gefahr
H- und P-Sätze H: 301-332 EUH: keine EUH-Sätze P: 301+310-304+340 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 20/22 S: (2)-28 MAK 1 mg·m−3 [1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bariumfluorid ist eine chemische Verbindung des Bariums und zählt zu den Fluoriden. Es ist ein farbloser kristalliner Feststoff.
Inhaltsverzeichnis
Vorkommen
In der Natur kommt Bariumfluorid in Form des seltenen Minerals Frankdicksonit vor.[4]
Gewinnung und Darstellung
Wenn sein Löslichkeitsprodukt überschritten ist, fällt Bariumfluorid beim Einengen barium- und fluoridhaltiger wässriger Lösungen aus.[5]
Eigenschaften
Wie Calcium- und Strontiumfluorid kristallisiert Bariumfluorid in der kubischen Fluoritstruktur. Neben der bei Normalbedingungen stabilen Struktur sind zwei Hochdruckmodifikationen bekannt, in ihnen ist das Barium neun- beziehungsweise elffach koordiniert.
Oberhalb von 3 GPa Druck bildet sich die orthorhombische Blei(II)-chlorid-Struktur, in der auch die anderen Bariumhalogenide kristallisieren. Eine weitere Phasenumwandlung erfolgt bei 12 GPa. Oberhalb dieses Druckes ist die hexagonale Ni2In-Struktur die stabilste.[6]
In der Gasphase sind Bariumfluorid-Moleküle entgegen den Vorhersagen des VSEPR-Modells nicht linear, sondern mit einem Winkel von 126° gewinkelt. Verantwortlich hierfür sind relativistische Effekte.[7]
Verwendung
Bariumfluorid-Einkristalle sind über einen weiten Bereich von 150 nm im Ultravioletten bis 15 μm im Infraroten optisch transparent. Dies kann für optische Geräte genutzt werden. Wie andere Fluoride ist Bariumfluorid ein Flussmittel für die Herstellung von Leichtmetallen, Legierungen und in der Email-Industrie.[8]
Wird Bariumfluorid mit Lanthanoiden dotiert, kann es als Material für Faserlaser genutzt werden.[8]
Einzelnachweise
- ↑ a b c d e f Eintrag zu Bariumfluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. Oktober 2009 (JavaScript erforderlich)
- ↑ H. Kojima, S. G. Whiteway, C. R. Masson: Melting points of inorganic fluorides. In: Canadian Journal of Chemistry. 1968, 46, 18, S. 2968–2971, doi:10.1139/v68-494,
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Bariumsalze“; Eintrag in der GESTIS-Stoffdatenbank des IFA, abgerufen am 31. März 2009 (JavaScript erforderlich)
- ↑ Mineralienatlas:Frankdicksonit
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1241.
- ↑ J. M. Leger, J. Haines, A. Atouf, O. Schulte: High-pressure x-ray- and neutron-diffraction studies of BaF2: An example of a coordination number of 11 in AX2 compounds. In: Phys. Rev. 1995, B 52, S. 13247–13256, doi:10.1103/PhysRevB.52.13247.
- ↑ Luis Seijo, Zoila Barandiarán, Sigeru Huzinaga: Ab initio model potential study of the equilibrium geometry of alkaline earth dihalides: MX2 (M=Mg, Ca, Sr, Ba; X=F, Cl, Br, I). In: J. Chem. Phys. 1991, 94, S. 3762 (1991), doi:10.1063/1.459748.
- ↑ a b Helmut Sitzmann: Bariumfluorid. In: Römpp Chemie Lexikon, Thieme Verlag, Stand Dezember 2007.
Schlagen Sie auch in anderen Wörterbüchern nach:
Barium — Eigenschaften … Deutsch Wikipedia
Bariumbromid — Kristallstruktur Ba2+ … Deutsch Wikipedia
Bariumchlorid — Kristallstruktur Ba2+ … Deutsch Wikipedia
Röntgenspeicherfolie — Röntgenspeicherfolien dienen in der Röntgendiagnostik dazu, das Schattenbild der Röntgenstrahlung aufzunehmen und ersetzen zunehmend die herkömmlichen Röntgenfilme. Die Speicherfolien in speziellen Kassetten sind in ihren Abmessungen zu den… … Deutsch Wikipedia
Bariumiodid — Kristallstruktur Ba2+ … Deutsch Wikipedia
Strontiumfluorid — Kristallstruktur Sr2+ F− … Deutsch Wikipedia

