- Berylliumacetat
-
Strukturformel 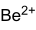
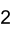
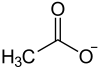
Allgemeines Name Berylliumacetat Andere Namen Berylliumdiacetat
Summenformel C4H6BeO4 CAS-Nummer 543-81-7 PubChem 10981 Kurzbeschreibung farbloser Feststoff
Eigenschaften Molare Masse 127,10 g·mol−1 Aggregatzustand fest
Schmelzpunkt > 60 °C (Zersetzung)[1]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 


Gefahr
H- und P-Sätze H: 350i-330-301-372-319-335-315-317-411 EUH: keine EUH-Sätze P: ? EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Sehr giftig Umwelt-
gefährlich(T+) (N) R- und S-Sätze R: 49-25-26-36/37/38-43-48/23-51/53 S: 45-53-61 LD50 22,5 mg·kg−1 (Ratte, ip)[4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Berylliumacetat ist eine chemische Verbindung des Berylliums aus der Gruppe der Carbonsäuresalze.
Inhaltsverzeichnis
Gewinnung und Darstellung
Berylliumacetat kann durch Reaktion von Berylliumoxidacetat in Eisessig mit Acetylchlorid gewonnen werden.[5] Das Berylliumoxidacetat wird durch Reaktion von wasserfreiem Berylliumchlorid und Essigsäureanhydrid hergestellt.[6]
Eigenschaften
Berylliumacetat ist ein nicht brennbarer Feststoff, welcher sich beim langsamem Erhitzen ab 60 - 100 °C, beim schnellen Erhitzen ab 150 - 180 °C zersetzt.[1] Es gibt langsam, beim Erhitzen schnell Essigsäureanhydrid ab und geht in Berylliumoxidacetat über[6], welches sublimiert.[2]
Beim schnellen Erhitzen erfolgt teilweise Zersetzung zu Essigsäureanhydrid und Berylliumoxid.[6]
Von kaltem Wasser wird es kaum angegriffen, hydratisiert aber in heißem Wasser.[2]
Verwandte Verbindungen
- basisches Berylliumacetat Be4O(CH3COO)6[7]
Einzelnachweise
- ↑ a b c d Eintrag zu CAS-Nr. 543-81-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Oktober 2010 (JavaScript erforderlich).
- ↑ a b c C. L. Parsons: "The Chemistry and Literature of Beryllium", Chemical Publishing (1909), S. 40. Volltext.
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Berylliumverbindungen“; Eintrag in der GESTIS-Stoffdatenbank des IFA, abgerufen am 31. März 2009 (JavaScript erforderlich)
- ↑ Beryllium (WHO).
- ↑ Georg Brauer: Handbuch Der Präparativen Anorganischen Chemie. Band 2, ISBN 3-432-87813-3, S. 899.
- ↑ a b c Kenneth A. Walsh: "Beryllium chemistry and Processing", ASM International (2009). S. 123f. (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Moeller, T.; Cohen, A. J.; Marvell, E. “Basic Beryllium Acetate and Propionate” Inorganic Syntheses 1950; Volume 3, 4-11. doi:10.1002/9780470132340.ch2
Kategorien:- Krebserzeugender Stoff
- Giftiger Stoff
- Sensibilisierender Stoff
- Umweltgefährlicher Stoff
- Berylliumverbindung
- Acetat
Wikimedia Foundation.




