- Dihydropyrimidin-Dehydrogenase
-
Dihydropyrimidin-Dehydrogenase —
Masse/Länge Primärstruktur 1022 Aminosäuren Sekundär- bis Quartärstruktur Homodimer Kofaktor FAD, FMN, 4Fe-4S Bezeichner Gen-Name DPYD Externe IDs OMIM: 274270 UniProt: Q12882 Enzymklassifikation EC, Kategorie 1.3.1.2 Oxidoreduktase Reaktionsart Redoxreaktion Substrat 5,6-Dihydrouracil + NADP+ Produkte Uracil + NADPH Vorkommen Übergeordnetes Taxon Eukaryoten, Bakterien Die Dihydropyrimidin-Dehydrogenase (DPD) ist ein Enzym aus der Gruppe der Oxidoreduktasen, das einen Schritt im Abbau von körpereigenen Pyrimidinen wie Uracil und Thymin katalysiert. Zusätzlich baut es verschiedene Cytostatika wie 5-Fluoruracil (5-FU) und Capecitabin ab. Eine Erbkrankheit, der DPD-Mangel (E79 nach ICD-10) führt dazu, dass sich diese Zytostatika bei der Krebstherapie im Körper anreichern und lebensbedrohliche Vergiftungen auslösen können. Bluttests für diese Erbkrankheit werden kommerziell angeboten.[1]
Inhaltsverzeichnis
Katalysierte Reaktionen
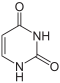
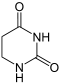
Uracil wird zu Dihydrouracil hydriert.
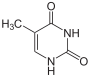
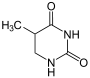
Thymin wird zu 5,6-Dihydrothymin hydriert.
Die katalysierte Reaktion ist reversibel und geschwindigkeitsbestimmend, das heißt, je nach Verfügbarkeit der Ausgangs- und Endprodukte stellt sich ein Gleichgewicht ein. Das Enzym ist in allen Eukaryoten, so auch dem Schleimpilz Dictyostelium, und vielen Bakterien zu finden. Ein naher Verwandter in Pflanzen ist die Dihydroorotat-Reduktase.[2]
Bedeutung und Hemmung
Bei etwa 5 % der Patienten, die 5-Fluoruracil als Zytostatikum erhielten, traten schwere Vergiftungssymptome bis hin zu Herzrhythmusstörungen auf. Vereinzelt wurde über Todesfälle berichtet. Grund für diese Reaktionen ist eine genetisch bedingte, verminderte Aktivität der Dihydropyrimidindehydrogenase.[3]
Das Enzym wird durch verschiedene Stoffe gehemmt, u. a.
- Bromvinyluracil, ein Abbauprodukt des Virostatikums Brivudin (deswegen kann die gleichzeitige Gabe von 5-FU bzw. seinen Vorläufern und Brivudin zu gefährlichen Interaktionen führen),
- Uracil,
- Eniluracil.
Einzelnachweise
- ↑ S. Maurer, J. Thödtmann: Das Mammakarzinom: Diagnostik und Therapie. Govi-Verlag, Eschborn, 2003, ISBN 978-3-77410996-4.
- ↑ ENZYM Eintrag
- ↑ H. Müller: Gentests: Antworten Zu Fragen Aus Der Medizinischen Praxis. Karger Publishers, 2005, ISBN 978-3-80557820-2.
Weblinks
 Wikibooks: Pyrimidin-Stoffwechsel – Lern- und LehrmaterialienKategorien:
Wikibooks: Pyrimidin-Stoffwechsel – Lern- und LehrmaterialienKategorien:- Oxidoreduktase
- Krankheitsassoziiertes Protein
Wikimedia Foundation.