- Hexafluoride
-
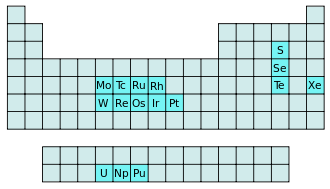
Die Hexafluoride sind eine Gruppe chemischer Verbindungen mit der Summenformel XF6. Von 16 Elementen sind stabile Hexafluoride bekannt. 9 dieser Elemente gehören zu den Übergangsmetallen, 3 zu den Actinoiden, und 4 sind Nichtmetalle.
Inhaltsverzeichnis
Eigenschaften
Physikalische Eigenschaften
Die meisten Hexafluoride sind kovalente Verbindungen mit niedrigen Schmelz- und Siedepunkten. 4 Hexafluoride (S, Se, Te, W) sind bei Raumtemperatur (25 °C) und Normaldruck (1013 mbar) gasförmig, 2 sind flüssig (Re, Mo), die anderen sind flüchtige Feststoffe. 3 Hexafluoride (S, Se, U) gehen beim Erwärmen durch Sublimation direkt in den gasförmigen Zustand über. Die Hexafluoride der Hauptgruppe (S, Se, Te, Xe) und der 6. Nebengruppe (Mo, W) sind farblos, die Farben der anderen Hexafluoride bewegen sich in Bereichen von gelb nach orange, rot, braun und schwarz.
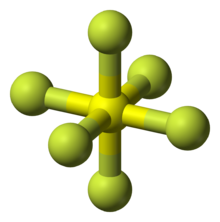
Die Molekulargeometrie ist im Regelfall oktaedrisch, eine Ausnahme ist Xenonhexafluorid. Die Verbindung ist quadratisch-bipyramidal (verzerrt oktaedrisch) aufgebaut. Die Struktur bildet gemäß VSEPR-Theorie auf Grund des noch vorhandenen freien Elektronenpaares ein pentagonal-pyramidales Molekül. Aufgrund quantenchemischer Berechnungen sollten ReF6 und RuF6 tetragonal verzerrte Strukturen besitzen (bei denen zwei der Bindungen einer Achse länger oder kürzer sind als die der anderen vier), dies konnte jedoch bisher nicht beobachtet werden.[1]
Verbindung Smp. (°C) Sdp. (°C) Sublp. (°C) Molare Masse Dichte (g·cm−3) Bindungslänge (pm) Farbe Schwefelhexafluorid[2] −50,8 146,05 6,63 156,4 farblos Selenhexafluorid[3] −46,6 192,95 8,69 167–170 farblos Tellurhexafluorid[4] −38,9 −37,6 241,59 3,16 (−40 °C)[5] 184 farblos Xenonhexafluorid[6] 49,48 75,6 245,28 3,56 farblos Molybdänhexafluorid[7] 17,5 34,0 209,94 3,50 (−140 °C)[1] 181,7[1] farblos Technetiumhexafluorid[8] 37,4 55,3 (212) 3,58 (−140 °C)[1] 181,2[1] gelb Rutheniumhexafluorid[9] 54 215,07 3,68 (−140 °C)[1] 181,8[1] dunkelbraun Rhodiumhexafluorid[10] ≈ 70 216,91 3,71 (−140 °C)[1] 182,4[1] schwarz Wolframhexafluorid[11] 2,3 17,1 297,84 4,86 (−140 °C)[1] 182,6[1] farblos Rheniumhexafluorid[12] 18,5 33,7 300,20 4,94 (−140 °C)[1] 182,6[1] gelb Osmiumhexafluorid[13] 33,4 47,5 304,22 5,09 (−140 °C)[1] 182,9[1] gelb Iridiumhexafluorid[14] 44 53,6 306,21 5,11 (−140 °C)[1] 183,4[1] gelb Platinhexafluorid[15] 61,3 69,1 309,07 5,21 (−140 °C)[1] 184,8[1] tiefrot Uranhexafluorid 56,5[16] 351,99 5,09[17] 199,6[18] farblos Neptuniumhexafluorid[19] 54,4 55,18 (358) 198,1[18] orange Plutoniumhexafluorid[20] 52 62 (356) 5,08[21] 197,1[18] braun Chemische Eigenschaften
Die Hexafluoride bieten ein breites Spektrum chemischer Reaktivität. Schwefelhexafluorid ist nahezu inert und ungiftig. Aufgrund seiner Stabilität, der dielektrischen Eigenschaften und der hohen Dichte findet es zahlreiche Anwendungen. Selenhexafluorid ist nahezu so unreaktiv wie SF6, dagegen ist Tellurhexafluorid giftig, nicht sehr stabil und kann durch Wasser innerhalb eines Tages hydrolysiert werden. Im Gegensatz dazu sind die Metallhexafluoride ätzend, leicht hydrolysierbar und können heftig mit Wasser reagieren. Einige von ihnen können als Fluorierungsmittel verwendet werden. Die Metallhexafluoride besitzen eine hohe Elektronenaffinität, die sie zu starken Oxidationsmitteln macht.[22] Platinhexafluorid zeichnet sich durch seine Fähigkeit aus, das Sauerstoff-Molekül (O2) zu oxidieren. Daher war es die erste Verbindung, die mit Xenon zur Reaktion gebracht wurde (siehe Xenonhexafluoroplatinat).
Verwendung
Einige der Metallhexafluoride finden aufgrund ihrer Flüchtigkeit praktische Anwendungen. Uranhexafluorid wird für die Uran-Anreicherung eingesetzt, um so Brennstoff für Kernreaktoren zu gewinnen. Die Fluoridflüchtigkeit wird ebenso für die Wiederaufarbeitung von Kernbrennstoffen genutzt. Wolframhexafluorid wird im Prozess der Chemischen Gasphasenabscheidung in der Herstellung von Halbleitern eingesetzt.[23]
Weitere Hexafluoride
Die Synthese von Poloniumhexafluorid (PoF6) wurde 1945 versucht, führte aber zu keinen eindeutigen Ergebnissen, der Siedepunkt wurde auf −40 °C geschätzt.[24] Ab-initio- und Dirac-Hartree-Fock-Berechnungen beschreiben einige Eigenschaften des noch nicht synthetisierten Radonhexafluorids (RnF6).[25] Americiumhexafluorid (AmF6) konnte durch direkte Fluorierung vom Americium(IV)-fluorid nicht dargestellt werden;[26] auch im Jahr 1990 ist die Synthese noch nicht erfolgt.[27]
Literatur
- N. P. Galkin, Yu N. Tumanov: „Reactivity and Thermal Stability of Hexafluorides“, in: Russ. Chem. Rev., 1971, 40 (2), S. 154–164; Abstract; doi:10.1070/RC1971v040n02ABEH001902.
Einzelnachweise
- ↑ a b c d e f g h i j k l m n o p q r s T. Drews, J. Supeł, A. Hagenbach, K. Seppelt: „Solid State Molecular Structures of Transition Metal Hexafluorides“, in: Inorganic Chemistry, 2006, 45 (9), S. 3782–3788; doi:10.1021/ic052029f; PMID 16634614.
- ↑ Eintrag zu Schwefelhexafluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. Oktober 2009 (JavaScript erforderlich).
- ↑ Eintrag zu Selenhexafluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. September 2009 (JavaScript erforderlich).
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Physical Constants of Inorganic Compounds, p. 4-94.
- ↑ Gmelins Handbuch der anorganischen Chemie, System Nr. 11, Tellur, Teil B 2, S. 26.
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Physical Constants of Inorganic Compounds, p. 4-98.
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Physical Constants of Inorganic Compounds, p. 4-77.
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Physical Constants of Inorganic Compounds, p. 4-93.
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Physical Constants of Inorganic Compounds, p. 4-86.
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Physical Constants of Inorganic Compounds, p. 4-85.
- ↑ Eintrag zu Wolframhexafluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. November 2007 (JavaScript erforderlich).
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Physical Constants of Inorganic Compounds, p. 4-85.
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Physical Constants of Inorganic Compounds, p. 4-79.
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Physical Constants of Inorganic Compounds, p. 4-68.
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Physical Constants of Inorganic Compounds, p. 4-81.
- ↑ Eintrag zu Uranhexafluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. Januar 2010 (JavaScript erforderlich).
- ↑ Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 97.
- ↑ a b c Masao Kimura, Werner Schomaker, Darwin W. Smith, Bernard Weinstock: „Electron-Diffraction Investigation of the Hexafluorides of Tungsten, Osmium, Iridium, Uranium, Neptunium, and Plutonium“, in: J. Chem. Phys., 1968, 48 (8), S. 4001–4012; doi:10.1063/1.1669727.
- ↑ C. Keller: „Die Chemie des Neptuniums“, in: Fortschr. chem. Forsch., 1969/70, 13/1, S. 1–124, hier: S. 71–75; Erste Seite.
- ↑ Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane, Teil C, S. 108–114.
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Properties of the Elements and Inorganic Compounds; Physical Constants of Inorganic Compounds, p. 4-81.
- ↑ N. Bartlett: „The Oxidizing Properties of the Third Transition Series Hexafluorides and Related Compounds“, in: Angewandte Chemie International Edition in English, 1968, 7 (6), S. 433–439; doi:10.1002/anie.196804331.
- ↑ „Tungsten and Tungsten Silicide Chemical Vapor Deposition“.
- ↑ Summary of work to date on volatile neutron source, Monsanto Chemical Company, Unit 3 abstracts of progress reports, August 16–31, 1945; Abstract; PDF.
- ↑ Michael Filatov, Dieter Cremer: „Bonding in Radon Hexafluoride: An Unusual Relativistic Problem?“, in: Phys. Chem. Chem. Phys., 2003, 5, S. 1103–1105; doi:10.1039/b212460m.
- ↑ John G. Malm, Bernard Weinstock, E. Eugene Weaver: „The Preparation and Properties of NpF6; a Comparison with PuF6“, in: J. Phys. Chem., 1958, 62 (12), S. 1506–1508; doi:10.1021/j150570a009.
- ↑ K. C. Kim, R. N. Mulford: „Vibrational Properties of Actinide (U, Np, Pu, Am) Hexafluoride Molecules“, in: Journal of Molecular Structure: THEOCHEM, 1990, 207 (3–4), S. 293–299; doi:10.1016/0166-1280(90)85031-H.
Kategorien:- Stoffgruppe
- Fluorverbindung
Wikimedia Foundation.