- Diethyläther
-
Strukturformel 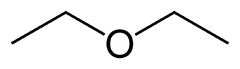
Allgemeines Name Diethylether Andere Namen - Ether
- Äther
- Diäthyläther
- Ethoxyethan
- Et2O
Summenformel C4H10O CAS-Nummer 60-29-7 ATC-Code N01AA01
Kurzbeschreibung farblose Flüssigkeit Eigenschaften Molare Masse 74,12 g·mol−1 Aggregatzustand flüssig
Dichte 0,71 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt 35 °C[1]
Dampfdruck Löslichkeit schlecht in Wasser (69 g/l bei 20 °C)[1], gut in vielen organischen Lösungsmitteln,
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Hoch-
entzündlichGesundheits-
schädlich(F+) (Xn) R- und S-Sätze R: 12-19-22-66-67 S: (2)-9-16-29-33 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln MAK 400 ml/m3, 1200 mg/m3[1]
WGK 1[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Diethylether bezeichnet in der Chemie eine organische Verbindung aus der Verbindungsklasse der Ether. Häufig wird er einfach als Ether, veraltet auch als Äther, bezeichnet. Die historische Bezeichnung war Schwefeläther wegen der Herstellung aus Ethanol und Schwefelsäure.
Inhaltsverzeichnis
Herstellung
Meist wird Ether aus einem Gemisch (etwa im Verhältnis 9:5) von Ethanol und Schwefelsäure hergestellt, wobei portionsweise Alkohol zur Schwefelsäure gegeben und dann bei 140 °C destilliert wird. Das unter Kühlung aufgefangene Destillat ist der in einer Kondensationsreaktion erhaltene Diethylether, als Rückstand verbleibt allerdings giftiges Diethylsulfat.
Beim Trocknen wird Ether über Calciumchlorid (CaCl2) vorgetrocknet, bevor das Restwasser mit Natrium entfernt werden kann.
Eigenschaften
Chemische und physikalische Eigenschaften
Die Verbindung ist besonders leicht flüchtig und hochentzündlich. Seine Dämpfe sind schwerer als Luft. Wegen seiner ansonsten aber verhältnismäßig geringen Reaktivität wird Diethylether für viele Reaktionen als Lösungsmittel (bspw. in Grignard-Reaktionen) eingesetzt, wegen seiner geringen Löslichkeit in Wasser ebenso als Extraktionsmittel. Durch Einwirkung von Licht in Anwesenheit von Luft-Sauerstoff bilden sich jedoch organische Peroxide, die leicht und explosionsartig wieder zerfallen können. Darum wird Ether in dunklen Flaschen aufbewahrt; vor Verwendung (Destillation) muss daher auf das Vorhandensein von Peroxiden geprüft werden.
Physiologische Eigenschaften
Das Inhalieren der Dämpfe ruft zunächst Erregung, dann Narkose hervor. Daher wurde Ether früher als Stärkungsmittel (Hoffmannstropfen) bzw. Narkotikum eingesetzt; letztere Verwendung geht auf das Jahr 1846 zurück. Heute wird er wegen langer Abklingzeit, unangenehmer Nachwirkungen (u. a. Erbrechen, Unruhe) und der Explosionsgefahr bei der Bildung von Gasgemischen mit Luft nicht mehr zur Narkose benutzt.
Gebrauch als Rauschmittel
Diethylether wird auch als Rauschmittel konsumiert.[3] Üblicherweise wird hierzu direkt aus der Flasche oder aus einem mit Ether getränkten Tuch inhaliert. Der Rausch selbst ruft starke emotionale Erregung, veränderte Bewusstseinswahrnehmung und wirre, psychotisch anmutende Gedankengänge hervor. Auch sehr unangenehme, teils traumatisierende Angstzustände sind nicht selten. Bei hoher Dosierung tritt der Konsument in einen apathischen Zustand über, in dem er nicht mehr ansprechbar ist. Nebenwirkungen des Konsums sind beim Schnüffeln gereizte Schleimhäute und beim Trinken Magenschleimhautentzündung. Da sich Diethylether mittlerweile in Apotheken nur noch schwer beschaffen lässt, ist der Konsum jedoch nicht sehr verbreitet.
Von Mitte bis Ende des 19. Jahrhunderts war Diethylether in Irland auf Grund hoher Alkoholpreise das häufigste verwendete Rauschmittel und wurde zu diesem Zweck in Apotheken verkauft.[4]
Verwendung
Von besonderer Bedeutung ist seine Verwendung als Lösungsmittel in der organischen Chemie. Besonders Reaktionen mit Metallorganylen wie Grignard-Verbindungen werden in wasserfreiem Ether durchgeführt. Das Schlenk-Gleichgewicht stabilisiert dabei die Grignard-Verbindung. Auch zur Flüssig-flüssig-Extraktion kann Diethylether verwendet, weshalb – insbesondere unter älteren Chemikern – oft noch der Begriff „ausethern“ für „extrahieren“ verwendet wird.
Die Verwendung als Lösemittel ist rückläufig. Inzwischen wird immer häufiger Methyl-tert-butylether (MTBE) verwendet, bei dem die Bildung explosiver Peroxide ausgeschlossen ist, der aber trotzdem sehr ähnliche Eigenschaften zeigt.
Diethylether wird unter anderem als Starthilfespray (z.B. unter dem Markennamen Startpilot) zum Anlassen von Verbrennungsmotoren verwendet.
Man kann Diethylether aufgrund der Verdunstung auch benutzen, um einen Unterdruck in Rundkolben herzustellen. So dient er z.B. zum Starten chemischer Reaktionen, wie z.B. dem Ammoniak / Chlorwasserstoff Springbrunnen.
Referenzen
- ↑ a b c d e f g Eintrag zu CAS-Nr. 60-29-7 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 08.01.2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 60-29-7 im European chemical Substances Information System ESIS
- ↑ Erowid
- ↑ G. Austin: Chronology of Psychoactive Substance Use.
Weblinks
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.
