- Diethylzink
-
Strukturformel 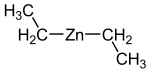
Allgemeines Name Diethylzink Andere Namen - Zinkdiethyl
- DEZ
Summenformel C4H10Zn CAS-Nummer 557-20-0 Kurzbeschreibung farblose Flüssigkeit [1]
Eigenschaften Molare Masse 123,51 g·mol−1 Aggregatzustand flüssig
Dichte 1,21 g·cm−3 [2]
Schmelzpunkt Siedepunkt Dampfdruck 21 hPa (20 °C)[1]
Löslichkeit reagiert äußerst heftig mit Wasser[3]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [4] 


Gefahr
H- und P-Sätze H: 250-260-314-410 EUH: 014 P: 210-273-280-305+351+338-309-310 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] 


Leicht-
entzündlichÄtzend Umwelt-
gefährlich(F) (C) (N) R- und S-Sätze R: 14-17-34-50/53 S: (1/2)-16-43-45-60-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Diethylzink, auch Zinkdiethyl oder DEZ genannt, ist eine metallorganische Verbindung, die aus zwei an Zink gebundenen Ethylgruppen besteht.
Inhaltsverzeichnis
Geschichte
Der Chemiker Edward Frankland (1825–1899) stellte Diethylzink erstmals 1848 aus Zink und Ethyliodid her.[5][6] Frankland arbeitete damals als Gast im Marburger Labor von Robert Bunsen. In jener Zeit diente Kohlenstoffdioxid als Schutzgas, welches im Kippschen Apparat erzeugt werden kann. In vielen Publikationen wird dies als die erste Synthese einer metallorganischen Verbindung beschrieben.[7] Es gab jedoch bereits zuvor andere Synthesen metallorganischer Verbindungen, wie beispielsweise 1840 die Synthese von Diethyltellur durch Friedrich Wöhler[8] oder 1760 die des Kakodyls durch Louis Claude Cadet de Gassicourt. Später verbesserte Frankland die Synthese, indem er das Ethyliodid durch Diethylquecksilber ersetzte.[9]
Darstellung und Gewinnung
Die Synthese von Diethylzink gelingt durch eine Umalkylierung von Triethylaluminium mittels Zinkchlorid, wobei das gewünschte Produkt vom Nebenprodukt Diethylaluminiumchlorid destillativ abgetrennt werden kann.[10]
Ein weiterer Weg zur Herstellung von Diethylzink ist die klassische Synthese aus Ethyliodid oder Ethylbromid mit einem Zink-Kupfer-Paar (aktiviertes Zink).[11][12]
Eigenschaften
Diethylzink ist eine farblose Flüssigkeit mit unangenehmem Geruch. Es reagiert sehr heftig mit Wasser und ist an Luft pyrophor. Die Handhabung muss daher unter einem Schutzgas, beispielsweise Stickstoff oder Argon, erfolgen.
Struktur
Die Kristallstruktur von Diethylzink weist eine tetragonale innenzentrierte Elementarzelle auf (Raumgruppe I41md). Die Moleküle bilden eine polare Kristallpackung wobei sich die beiden Ethylgruppen in cis-Stellung anordnen. The Zn-C Bindungen sind 194.8(5) pm lang, während der C-Zn-C Winkel mit 176.2(4)° leicht gebogen ist.[13]
In der Gasphase sind die Zinkatome linear koordiniert. Die Zn-C Bindungen betragen 195.0(2) pm.[14]
Verwendung
Diethylzink wird in der organischen Synthese sehr vielfältig eingesetzt, da sich damit hochfunktionalisierte Stoffe herstellen lassen, die wichtige Ausgangsstoffe zur Herstellung von Pharmazeutika, Naturstoffderivaten, Polymeren und vielen anderen Verbindungen sind. Im Gegensatz zu vielen anderen metallorganischen Verbindungen toleriert Diethylzink eine Vielzahl von funktionellen Gruppen. Ein weiterer Vorteil gegenüber anderen metallorganischen Verbindungen ist, dass Diethylzink in Gegenwart geeigneter Katalysatoren oftmals stereo- und regioselektiv mit organischen Verbindungen reagiert.[15][16][17][18]
Diethylzink wird aktuell in großen Mengen in der Solarindustrie zur Herstellung von TCO-Schichten aus Zinkoxid für Dünnschicht-Solarzellen verwendet.
Diethylzink wirkt als nukleophiles Ethyl-Synthon in Additionsreaktionen von Carbonylgruppen. Mit Diiodmethan bildet es das reaktive Agens in der Simmons-Smith-Reaktion.[19][20]
In einem Projekt der Library of Congress in Washington D.C. wurde DEZ über viele Jahre als Mittel zur Massenentsäuerung verwendet, um wertvolle Bücher und andere Schriftstücke vor dem Säurezerfall zu schützen. Nach einem Unglücksfall, bei dem DEZ-Reste mit Feuchtigkeit in einer Präparationskammer zur Reaktion kamen und zu einer Detonation führten, wurden das Projekt beendet.[21]
Einzelnachweise
- ↑ a b c Eintrag zu Diethylzink in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. Feb. 2008 (JavaScript erforderlich).
- ↑ a b c Datenblatt Diethylzinc bei Sigma-Aldrich, abgerufen am 17. April 2010.
- ↑ Roth/Weller Gefährliche Chemische Reaktionen, ecomed Sicherheit-Verlag, 59. Ergänzungslieferung 11/2009.
- ↑ a b Eintrag zu CAS-Nr. 557-20-0 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ E. Frankland, In: Liebigs Annalen der Chemie und Pharmacie, 71/1849, S.213.
- ↑ E. Frankland, On the isolation of the organic radicals. In: Journal of the Chemical Society, 2/1850, S.263.
- ↑ M. Bodenstein, Robert Wilhelm Bunsens Stellung zur organischen Chemie. In: Naturwissenschaften, 24/1936, S.193-6.
- ↑ F. Wöhler, in: Liebigs Annalen der Chemie und Pharmacie, 35/1840, S.111.
- ↑ E. Frankland, B. F. Duppa, On a new reaction for the production of the zinc-compounds of the alkyl-radical. In: Journal of the Chemical Society, 17/1864, S.29-36.
- ↑ Krause, M.J.; Orlandi, F.; Saurage, A.T.; Zietz Jr., J.R.: Organic Aluminium Compounds in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a01_543.
- ↑ C. R. Noller, Diethyl Zinc. In: OrgSynth, 2/1943, S.184.
- ↑ P. Bolze, Metallorganische Chemie, Universität Marburg.
- ↑ John Bacsa, Felix Hanke, Sarah Hindley, Rajesh Odedra, George R. Darling, Anthony C. Jones and Alexander Steiner: The Solid State Structures of Dimethylzinc and Diethylzinc. In: Angewandte Chemie International Edition. 50, 2011, S. 0000-0000. doi:10.1002/anie.201105099.
- ↑ A. Haaland, J. C. Green, G. S. McGrady, A. J. Downs, E. Gullo, M. J. Lyall, J. Timberlake, A. V. Tutukin, H. V. Volden, K.-A. Østby: The length, strength and polarity of metal–carbon bonds: dialkylzinc compounds studied by density functional theory calculations, gas electron diffraction and photoelectron spectroscopy. In: Dalton Transactions. 2003, S. 4356-4366. doi:10.1039/B306840B.
- ↑ K. Stingl und J. Martens: Synthesis of chiral Catalysts for the enantioselective Addition of Diethylzinc to aromatic Aldehydes, Synth. Commun. 22 (1992) 2745-2756.
- ↑ S. Wallbaum und J. Martens : Catalytic Enantioselective Addition of Diethylzinc to Aldehydes: Application of a new Bicyclic Catalyst, Tetrahedron : Asymmetry 4 (1993) 637-640.
- ↑ T. Mehler und J. Martens : New Thioether Derivatives as Catalysts for the Enantioselective Addition of Diethylzinc to Benzaldehyde, Tetrahedron : Asymmetry 5 (1994) 207-210.
- ↑ S. Lang u.a., Highly reactive Zink form, method for the production thereof, and use of the same. In: WO2007/020298, 22. Februar 2007.
- ↑ A. B. Charette, H. Lebel, (2S,3S)-(+)-(3-Phenylcyclopropyl)methanol. In: OrgSynth, 10/2004, S.613.
- ↑ Y. Ito u.a., One-Carbon Ring Expansion of Cycloalkanones to Conjugated Cycloalkenones: 2-Cyclohepten-1-one. In: OrgSynth, 6/1988, S.327.
- ↑ N. Baker, Double Fold: Libraries and the Assault on Paper., Vintage, 2002, ISBN 0-375-72621-7.
Literatur
- M. H. Abraham, J. A. Hill, Organometallic compounds 3. The acidolysis of some symmetrical-and unsymmetrical-dialkylzincs by primary amines. In: Journal of Organometallic Chemistry, 7/1967,S.23-33.
- M. J. Rozema u.a., Preparation of polyfunctional diorganomercurials and their transmetallation to diorganozincs. Applications to the preparation of optically active secon., Elsevier, 1962.
- A. G. Davies, Studies of homolytic organometallic reactions. In: Journal of Organometallic Chemistry, 200/1980, S.87-99.
- J. Boersma, Zinc and cadmium. In: Journal of Organometallic Chemistry, 147/1978, S.1-16.
Kategorien:- Feuergefährlicher Stoff
- Ätzender Stoff
- Umweltgefährlicher Stoff
- Metallorganische Verbindung
- Zinkverbindung
Wikimedia Foundation.

