- Doppelbindung
-
Eine Doppelbindung ist eine Form der chemischen Bindung, bei der zwei Atome über zwei verschiedene Atombindungen verknüpft werden.[1] Meist besteht eine Doppelbindung aus einer σ- und einer π-Bindung.
Inhaltsverzeichnis
Geschichtliches
Die Darstellung der Doppelbindung durch zwei Doppelstriche wurde von Joseph Loschmidt eingeführt. Um 1865 führte August Wilhelm von Hofmann die Endungen -an, -en, -in zur Bezeichnung von gesättigten und ungesättigten Alkanen ein.
Detailbeschreibung
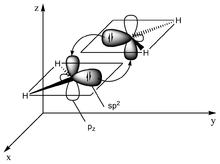
Die Bindungsverhältnisse eines Moleküls der 2. Periode mit Doppelbindung lassen sich mit sp2 Hybrid-Orbitalen beschreiben. Die benachbarten Atome eines solchen Atoms mit sp2-Hybridisierung befinden sich in einer Ebene (das Molekül ist planar). Die Winkel zwischen den gebundenen Atomen liegen meist nahe bei 120° (siehe VSEPR-Modell), der Abstand der bindenden Atome liegt bei etwa 1,34 Å. Das verbleibende Elektron befindet sich in einem Orbital mit reinem p-Charakter senkrecht zur Molekülebene. Jedes der beiden Atome, die durch die Doppelbindung verbunden sind, weisen jeweils ein solches einfach besetztes p-Orbital auf. Durch Kombination dieser beiden entsteht ein bindendes π-Orbital und ein antibindendes π*-Orbital.
Dieser Typ von Doppelbindung ist zwar nicht auf die 2. Periode beschränkt, doch findet man bei Doppelbindungen zwischen Elementen der höheren Perioden andere Bindungsmuster. Ursache hierfür sind einerseits generell geringere homonukleare Bindungsenergien bei größeren Atomen und andererseits eine geringere Hybridisierungstendenz der s- und p-Valenzorbitale. Das Zusammentreffen dieser Phänomene bringt es in bestimmten Fällen mit sich, dass die Energie, die benötigt wird, die dem Doppelbindungssystem zugrunde liegenden Molekülfragmente in einen bindungsfähigen Zustand zu bringen, durch die anschließend freiwerdende Bindungsenergie nicht mehr aufgebracht werden kann. In solchen Fällen erhält man entweder diese Fragmente (d. h. Carbenhomologe oder -analoge Moleküle), als isolierbare Verbindungen oder die Dimerisierung erfolgt über eine doppelte Lewis-Säure-Base-Reaktion und ergibt zwei Donator-Akzeptor-Bindungen (eine doppelte dative Bindung). Erkennbar ist eine solche Doppelbindung, die beispielsweise bei den höheren Kohlenstoffhomologen beobachtet wird, an einer charakteristischen Struktur (trans-bent-Abwinkelung der Substituenten) sowie der geringen Energie, die zur Bindungstrennung notwendig ist. Die Dissoziationsenergie kann sogar deutlich kleiner sein als für eine normale kovalente Einfachbindung. Typische Beispiele für derartige Doppelbindungssysteme sind Distannene (R2Sn=SnR2) und Diplumbene (R2Pb=PbR2).
Mehrere Doppelbindungen, die durch genau eine Einfachbindung getrennt sind, bezeichnet man als konjugiert, direkt aneinander grenzende als kumuliert und bei mehr als einer Einfachbindung bis zur nächsten Doppelbindung als isoliert.
Die Energielücke zwischen dem bindenden π- und dem antibindenden π*-Orbital ist in der Regel kleiner als die Energielücke zwischen einem entsprechenden σ- und einem antibindenden σ*-Orbital. Im Falle konjugierter Doppelbindungen sinkt die Anregungsenergie soweit ab, dass bereits sichtbares Licht ausreichen kann, um ein Elektron in ein leeres Orbital anzuheben. Dabei wird umso weniger Energie (längerwelliges Licht) benötigt, je größer die Anzahl der konjugierten Doppelbindungen ist (siehe hierzu auch: Teilchen im Kasten). Im Falle von Carotin mit elf konjugierten Doppelbindungen wird blaues Licht absorbiert und das Molekül erscheint orange (die Komplementärfarbe orange entsteht aus der Subtraktion des blauen Anteils vom eingestrahlten weißen Licht).
Beispiele
C=O-Doppelbindung finden sich beispielsweise in Aldehyden, Ketonen und Carbonsäureestern, C=N-Doppielbindungen in Iminen, Oximen, Hydrazonen etc. und C=C-Doppelbindungen in Alkenen.
Typische Chemische Reaktionen von Molekülen mit einer Doppelbindung
- C=C Doppelbindung (Alkene):
-
- Elektrophile Addition an die Doppelbindung
- ein weiteres (elektrophiles) Molekül lagert sich entweder nach Angriff von E+ (E+ = Elektrophil) und ionischer Zwischenstufe unter Bruch der Doppelbindung an das Molekül an oder bei Elektrophilen mit größeren Atomen (z. B. Brom) unter Bildung einer ringförmigen, ionischen Zwischenstufe („-onium-Ion“, hier also Bromonium-Ion) mit anschließendem Rückseitenangriff des Restes (im Beispiel Br−).
- Radikalische Addition an die Doppelbindung
- ein Molekül, dessen Bindung leicht homolytisch (in zwei Radikale) spaltbar ist, (z. B. Chlor) wird unter Licht (UV) in zwei Radikale gespalten, die dann die Doppelbindung angreifen.
- Elektrophile Addition an die Doppelbindung
-
- C=O-Doppelbindung (Carbonyl, Keton, Aldehyd, Carbonsäure, Carbonsäureester):
-
- Reduktion der C=O-Bindung zu Alkohol mit reduzierenden Reagenzien wie Wasserstoff oder Grignard-Reaktionen.
- Oxidation der C=O-Bindung (nur Aldehyd) zu einer Carbonsäure.
- Passerini-Reaktion.
-
- C=N-Doppelbindung
-
- Addition von Blausäure unter Bildung von α-Aminonitrilen.
- Ugi-Reaktion
-
- Perizyklische Reaktionen
weitere Reaktionen siehe auch Namensreaktionen, Kumulierte Doppelbindung.
Nachweis von C=C-Doppelbindungen
Ein recht unspezifischer Nachweis von organischen Verbindungen mit C=C-Doppelbindungen, d.h. von Alkenen, ist über Bromwasser möglich. Bei Anwesenheit eines Alkens wird das durch Br2 gelbgefärbte Bromwasser nach Schütteln mit der Stoffprobe entfärbt. Über eine Additionsreaktion entsteht aus dem Alken ein Bromalkan. Zu Details siehe Alkennachweis.
Siehe auch
- Doppelbindungsregel
- Doppelbindungsäquivalent
- Cis-trans-Isomerie (Z)-(E)-Isomerie
- π-π-Wechselwirkung
Einzelnachweise
- ↑ Otto-Albrecht Neumüller (Herausgeber): Römpps Chemie Lexikon, Frank'sche Verlagshandlung, Stuttgart, 1983, 8. Auflage, S. 1003, ISBN 3-440-04513-7.
MehrfachbindungenDoppelbindung | Dreifachbindung | Vierfachbindung | Fünffachbindung
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Doppelbindung — nimmt man in denjenigen Kohlenstoffverbindungen an, die mehrere, mindestens zwei Kohlenstoffatome in der Molekel enthalten, die benachbart stehen und nur je zwei Valenzen anderweitig gesättigt haben, so daß gemäß der Vierwertigkeit der… … Lexikon der gesamten Technik
Doppelbindung — Doppelbindung, die chemische Bindung mehrwertiger Atome durch zwei Wertigkeiten. Das einwertige Chlor Cl ist im Chlorwasserstoff HCl an den einwertigen Wasserstoff H nur mit Einer Wertigkeit gebunden H Cl, die Atome des zweiwertigen Sauerstoffes… … Meyers Großes Konversations-Lexikon
Doppelbindung — Dọp|pel|bin|dung 〈f. 20; Chem.〉 Verbindung zweier Atome durch je zwei Elektronenpaare, z. B. die Verbindung der Kohlenstoffatome im Ethen, H2C=CH2 * * * Dọp|pel|bin|dung: in chem. Verb. zwischen zwei gleich oder verschiedenartigen Atomen… … Universal-Lexikon
Doppelbindung — dvilypis ryšys statusas T sritis fizika atitikmenys: angl. double bond vok. Doppelbindung, f rus. двойная связь, f pranc. liaison double, f … Fizikos terminų žodynas
Doppelbindung (Psychologie) — Die Doppelbindungstheorie (engl. double bind theory, franz. double contrainte) ist eine kommunikationstheoretische Vorstellung zur Entstehung schizophrener Erkrankungen.[1] Die Theorie wurde von einer Gruppe um den Anthropologen und… … Deutsch Wikipedia
Isolierte Doppelbindung — Eine Doppelbindung ist eine Form der chemischen Bindung, bei der zwei Atome über zwei verschiedene Atombindungen verknüpft werden. Meist besteht eine Doppelbindung aus einer σ und einer π Bindung. Entstehung einer normalen Doppelbindung … Deutsch Wikipedia
Theorie der Doppelbindung — Die Doppelbindungstheorie (engl. double bind theory, franz. double contrainte) ist eine kommunikationstheoretische Vorstellung zur Entstehung schizophrener Erkrankungen.[1] Die Theorie wurde von einer Gruppe um den Anthropologen und… … Deutsch Wikipedia
Konjugierte Doppelbindung — Unter Konjugation versteht man in der Chemie die Überlappung von π Orbitalen (π=PI), einer π Bindung mit einem p Orbital eines sp2 hybridisierten (Kohlenstoff )Atoms oder mit weiteren π Orbitalen. Im ersteren Falle (konjugierte Radikale,… … Deutsch Wikipedia
Kumulierte Doppelbindung — Bei kumulierten Doppelbindungen liegen zwei Doppelbindungen benachbart. Einfache Verbindungen mit kumulierten Doppelbindungen sind z. B. das Propadien (Allen) H2C=C=CH2 und das Kohlenstoffdioxid O=C=O. Ein Kohlenstoffatom zwischen zwei… … Deutsch Wikipedia
Doppelbindungen — Eine Doppelbindung ist eine Form der chemischen Bindung, bei der zwei Atome über zwei verschiedene Atombindungen verknüpft werden. Meist besteht eine Doppelbindung aus einer σ und einer π Bindung. Entstehung einer normalen Doppelbindung … Deutsch Wikipedia
- C=C Doppelbindung (Alkene):