- Allosterischer Effektor
-
Der Begriff Allosterie - von griech. ἄλλως allos (anders) und στερεός stereós (Ort), das heißt " am anderen Ort" - entstammt dem Bereich der Biochemie, dort der Proteinfunktion.
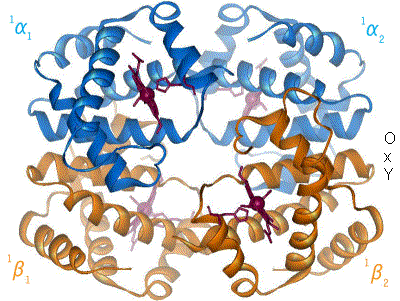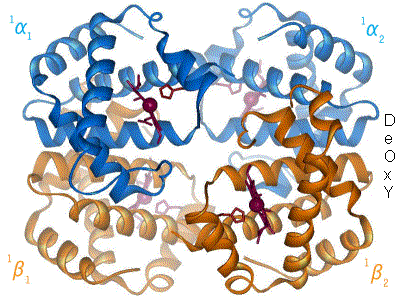 Beispiel für Allosterie: Hämoglobin im Wechsel zwischen T- und R-Form.
Beispiel für Allosterie: Hämoglobin im Wechsel zwischen T- und R-Form.Er wird in der Literatur unterschiedlich gebraucht. So gilt er zunächst für Proteine, die bestimmte regulatorisch wirksame Moleküle (Effektoren) an anderer Stelle binden als ihr Substrat (Enzym) bzw. ihren zentralen Liganden (Carrier bzw. Rezeptor). Fälle, in denen die Bindungsstärke von der Zahl der bereits gebundenen Substrat- oder Ligandenmoleküle abhängt, gehören ebenfalls dazu.
Allosterie bedeutete zunächst die Veränderung der Raumstruktur unter Beeinflussung des aktiven Zentrums/Bindungszentrums. Manche Autoren meinen, dass für den allosterischen Effekt auf jeden Fall eine kooperative Wechselwirkung zwischen separaten Untereinheiten eines (oligomeren) Proteins notwendig ist; danach dürften bei monomeren Proteinen keine allosterischen Effekte auftreten. Indessen kennt man auch bei solchen Proteinen Veränderungen der Raumstruktur durch kleine Moleküle, die einen Einfluss auf das aktive Zentrum haben können. Es hat sich daher eingebürgert, auch diese Phänomene unter den Begriff der Allosterie zu subsumieren. Für das Beispiel der Phosphofructokinase bedeutet dies: jede Polypeptidkette ist hier als Fusion zweier Untereinheiten (C und R) zu sehen. Jede dieser Untereinheiten bindet ATP, C in seiner Eigenschaft als Substrat (Coenzym) und R in seiner Eigenschaft als allosterischer Inhibitor.
Prototyp eines allosterischen Proteins ist das Hämoglobin, bei dem die Bindungsstärke des Sauerstoffs (O2) von einer Reihe an Effektoren, insbesondere aber davon abhängt, wie viele der insgesamt vier O2-Bindungsplätze bereits besetzt sind. Bei höheren Sauerstoff-konzentrationen/-beladungen ist der Übergang von einem nieder-affinen "T-Zustand" (T für tense, engl. = straff, angespannt) in den hoch-affinen "R-Zustand" (R für relaxed, engl. = entspannt) zu verzeichnen. Die Tatsache, dass nachfolgende O2-Moleküle zunehmend stärker gebunden werden, bezeichnet man auch als positive Kooperativität. Der Hill-Koeffizient ist ein Maß für die Kooperativität.
Siehe auch
Wikimedia Foundation.
