- Natriumjodid
-
Kristallstruktur 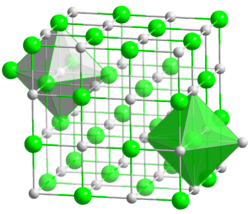
__ Na+ __ I- Kristallsystem kubisch Raumgruppe 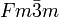
Koordinationszahlen Na[6], I[6] Allgemeines Name Natriumiodid Verhältnisformel NaI CAS-Nummer 7681-82-5 ATC-Code Kurzbeschreibung wasserlöslicher, farbloser Feststoff Eigenschaften Molare Masse 149,89 g·mol−1 Aggregatzustand fest
Dichte 3,67 g·cm−3 (20°C)[1]
Schmelzpunkt 662 °C[1]
Siedepunkt 1304 °C[1]
Dampfdruck vernachlässigbar
Löslichkeit gut in Wasser (1793 g·l−1 bei 20 °C[1])
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 4340 mg·kg−1 (Ratte, oral) [2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumiodid (veraltet Natriumjodid) ist ein weißes, kristallines Salz mit der Summenformel NaI, das zum Nachweis ionisierender Strahlung, zur Behandlung von Iodmangel und zur Herstellung von Iodalkanen in der Finkelstein-Reaktion benutzt wird.
Inhaltsverzeichnis
Eigenschaften
Löslichkeit[3] Lösungsmittel Löslichkeit von NaI
g NaI / 100 g Lösungsmittel bei 25 °CH2O 184 Ammoniak 162 Schwefeldioxid (flüssig) 15 Methanol 62,5 – 83,0 Ameisensäure 61,8 Acetonitril 24,9 Aceton 28,0 Formamid 57 – 85 Acetamid 32,3 Dimethylformamid 3,7 – 6,4 Verwendung
Natriumiodid wird allgemein zur Behandlung und als Vorsorge gegen Iodmangel verwendet. Die radioaktiven Isotope 123Iod und 131Iod werden als Natriumiodid zur nuklearmedizinischen Diagnostik – insbesondere zur Schilddrüsenszintigrafie – verwendet. 131Iod wird als Natriumiodid im Rahmen der Radioiodtherapie als Therapeutikum eingesetzt.
Natriumiodid wird in der Polymerase-Kettenreaktion benutzt. Ein weiteres Einsatzgebiet ist die Finkelstein-Reaktion. Hierbei wird ein Alkylchlorid oder -bromid mit Natriumiodid in Aceton behandelt.
Hierbei verdrängt die bessere Abgangsgruppe Iodid die schlechtere Abgangsgruppe Chlorid. Die Triebkraft der Reaktion ist die geringe Löslichkeit des Natriumchlorids in Aceton, durch welche das Gleichgewicht auf die Seite des Alkyliodids verschoben wird. Neben Aceton können auch THF und Acetonitril als Lösungsmittel verwendet werden.
Weiterhin gibt zahlreiche der Finkelstein-Reaktion analoge Reaktionen, wie z.B. die Darstellung von Trimethylsilyliodid aus Trimethylsilylchlorid, Acetyliodid aus Acetylchlorid u.v.m.
In Kristallen, die mit Thallium dotiert sind, NaI(Tl), entstehen durch ionisierende Strahlung Photonen und können so als Szintillationsdetektor eingesetzt werden, traditionell in der Nuklearmedizin, Geophysik, Kernphysik, usw. NaI(Tl) ist das am weitesten verbreitetste Szintillationsmaterial, da es das meiste Licht produziert. Die Kristalle werden normalerweise mit einem Photomultiplier gekoppelt und hermetisch abgeschlossen, da NaI hygroskopisch ist. Einige Parameter (Strahlungshärte, Nachleuchten, Transparenz) können dadurch beeinflusst werden, dass man die Bedingungen, unter denen der Kristall wächst, kontrolliert. Kristalle mit höherer Dotierung werden als Röntgendetektoren mit hoher spektroskopischer Qualität eingesetzt. Natriumiodid kann als Einkristall oder polykristallin eingesetzt werden.Quellen
- ↑ a b c d e Eintrag zu Natriumiodid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 14.10.2007 (JavaScript erforderlich)
- ↑ Natriumiodid bei ChemIDplus
- ↑ Burgess, J. Metal Ions in Solution(Ellis Horwood, New York, 1978)ISBN 0-85312-027-7
Siehe auch
Wikimedia Foundation.
