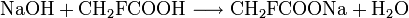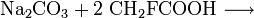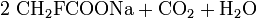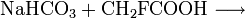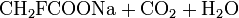- Natriummonofluoracetat
-
Strukturformel 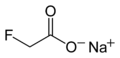
Allgemeines Name Natriumfluoracetat Andere Namen - Natriummonofluoressigsäure
- Fluoressigsäure Natriumsalz
- Compound 1080
- Fratol
Summenformel C2H2FO2Na CAS-Nummer 62-74-8 Kurzbeschreibung farbloser kristalliner Stoff Eigenschaften Molare Masse 100,0 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit löslich in Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Sehr giftig Umwelt-
gefährlich(T+) (N) R- und S-Sätze R: 26/27/28-50 S: (1/2)-13-22-36/37-45-61 MAK 0,05 mg·m−3[3]
LD50 WGK 2[6] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumfluoracetat, auch als Natriummonofluoracetat bezeichnet, ist ein farbloses und hochgiftiges Natriumsalz der Fluoressigsäure.
Inhaltsverzeichnis
Herstellung
Natriumfluoracetat bildet sich beispielsweise bei der Reaktion von Natronlauge, Natriumcarbonat oder Natriumhydrogencarbonat mit Fluoressigsäure.
Eigenschaften
Natriumfluoracetat ist ein farb- und geruchloses Pulver, das in Wasser leicht löslich ist. Der Schmelzpunkt liegt bei 200 °C.
Vorkommen
Das Salz ist in über 40 Pflanzen Australiens, Brasiliens und Afrikas enthalten. Beispielsweise kommt es in den Blättern der südafrikanischen Pflanze «Gifblaar» (Dichapetalum cymosum) vor. Es ist für eine Vielzahl von Viehvergiftungen verantwortlich. Bereits ein Blatt reicht aus, um ein Schaf zu töten.[7]
Es ist eine von wenigen natürlichen Fluor-organischen Verbindungen. In außerordentlich kleinen Mengen konnte die Verbindung auch in Teeblättern nachgewiesen werden.[8]
Toxizität
Natriumfluoracetat ist sowohl bei oraler Aufnahme, als auch bei Inhalation der Stäube oder von Nebeln wässriger Lösungen, als auch bei direktem Hautkontakt, für den Menschen, alle Säugetiere und viele Insekten, außerordentlich toxisch. Nach der Aufnahme des Giftes treten beim Menschen nach etwa 30 Minuten bis maximal drei Stunden erste Symptome einer Vergiftung auf. Brechreiz, Erbrechen zusammen mit Bauchschmerzen, sowie Schweißausbrüche, Verwirrung und Unruhe. Hinzu kommen meist noch Muskelkrämpfe, Atemnot und Zyanose. Der Tod wird meist durch eine ventrikuläre Tachykardie hervorgerufen.
Für den Menschen wurde die letale Dosis auf 5 bis 10 mg·kg−1 Körpergewicht hochgerechnet.[9]
Subletale Dosen führen zu Gewebschäden in Organen mit erhöhtem Energiebedarf, speziell im Gehirn, den Keimdrüsen, Herz und Lunge.
Katzen können sich durch den Verzehr von vergifteten Nagern vergiften (siehe Verwendung). Die letale Dosis LD50für Katzen liegt bei 0,3 bis 0,5 mg·kg−1.[10] Für verschiedene Vogelarten wie Haussperling und Star wurden LD50-Werte von 2 bis 3 mg·kg−1 ermittelt. Bei Meerschweinchen liegt die letale Dosis 50 bei 0,3 mg·kg−1.[11][5]
Für wirbellose Wassertiere (EC50 = 350 mg a.i./Liter), als auch für Fische (LC50 = 54–970 mg a.i./Liter) ist die Verbindung dagegen nahezu ungiftig (EC=effektive Konzentration, LC= letale Konzentration).[12]
Die hohe Toxizität, die leichten Beschaffungsmöglichkeiten oder die einfache Herstellung von Natriumfluoracetat machen diese Verbindung zu einer potenziellen Waffe in der Hand von Terroristen.[13]
Wirkungsmechanismus
Nach der Aufnahme wird Natriumfluoracetat im Körper zu Fluorcitrat metabolisiert. Dieses Derivat der Zitronensäure hemmt das Enzym Aconitase, das normalerweise die Umwandlung von Citrat in cis-Aconit katalysiert. Dadurch wird der Citratzyklus unterbrochen und im Körper reichert sich Citrat an. Die Körperzellen werden dadurch von der Energiezufuhr abgeschnitten. Zellen mit hohem Energiebedarf sind davon am stärksten betroffen.[14]
Gegengifte
Die Behandlung einer Vergiftung mit Natriumfluoracetat ist, bedingt durch den Eingriff in den Citronensäurezyklus, sehr schwierig. Sobald der Vergiftete Symptome zeigt, ist der Zyklus außer Betrieb gesetzt. Es ist kein effektives Antidot bekannt. In der Klinik sind die Gabe von Muskelrelaxantien, eines Antikonvulsivums und künstliche Beatmung als unterstützende Maßnahmen hilfreich. Es liegen nur wenige Erfahrungen bei der Behandlung von entsprechenden Vergiftungen vor.
Verwendung
In vielen Ländern ist Natriumfluoracetat als Rodentizid zur Bekämpfung von Nagetieren und anderen Säugern zugelassen.[15] In Neuseeland wird es gegen Possums eingesetzt, in den USA gegen Kojoten. Daneben wird es in Australien, Mexiko und Israel verwendet.[14] In Kanada wird es in den Provinzen Alberta und Saskatchewan gegen Wölfe und Kojoten eingesetzt.[12]
In einigen Veröffentlichungen wird die vorteilhafte Verwendung von 18F-Fluoracetaten als Tumormarker für die Bildgebung bei der Positronen-Emissions-Tomografie von Prostatakarzinomen gezeigt.[16] Da für solche Aufnahmen nur picomolare Mengen eines Tracers benötigt werden, spielt die Toxizität von Natriumfluoracetat in diesem Fall keine Rolle. Das Verfahren befindet sich noch in der Entwicklungsphase.
Einzelnachweise
- ↑ a b Eintrag zu Natriumfluoracetat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 31.12.2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 62-74-8 im European chemical Substances Information System ESIS
- ↑ TRGS 900, Oktober 2000
- ↑ Yakkyoku, in Pharmacy, 28/1977, S.329–39. (in japanisch)
- ↑ a b Ward JC, Rodent control with 1080, ANTU, and other war-developed toxic agents., in Am J Public Health Nations Health, 36/1946, S.1427–31.
- ↑ OCONUS Compliance Assessment Protocols, Federal Republic of Germany, September 1998
- ↑ ETH Zürich, Brauckmann B, Eingefügtes Fluor führt zu ganz neuen Substanzeigenschaften
- ↑ Vartiainen T, Kauranen P , The determination of traces of fluoroacetic acid by extractive alkylation, pentafluorobenzylation and capillary gas chromatography-mass spectrometry., in Anal Chim Acta, 157/1984, S.91–7.
- ↑ Fluoridealert.org, Sodium fluoroacetate, abgerufen am 31. Dezember 2007
- ↑ Kraft WR et.al., Katzenkrankheiten, 2003, S.121, ISBN 3794401999
- ↑ fluoridealert.org, Sodium Fluoroacetate (also known as 1080), abgerufen am 31. Dezember 2007
- ↑ a b Pest Management Regulatory Agency, Re-evaluation of Sodium Monofluoroacetate, 18. Juni 2004
- ↑ Holstege CP et.al., Unusual but potential agents of terrorists., in Emerg Med Clin North Am., 25/2007, S.549–66. PMID 17482032
- ↑ a b Proudfoot AT et.al., Sodium fluoroacetate poisoning., in Toxicol Rev, 25/2006, S.213–9. PMID 17288493
- ↑ Sodium fluoroacetate (Compound 1080). US EPA Fact Sheet. August 1990
- ↑ Ponde DE et.al., 18F-fluoroacetate: a potential acetate analog for prostate tumor imaging – in vivo evaluation of 18F-fluoroacetate versus 11C-acetate., in J Nucl Med., 48/2007, S.420–8.
Literatur
- Hüter F, Moderne Nagetiervertilgungsmittel, in Journal of Pest Science, 23/1950, S.49–51.
- Goh CS et.al., Sodium monofluoroacetate (Compound 1080) poisoning in dogs., in Aust Vet J., 83/2005, S.474–9. PMID 16119418
Wikimedia Foundation.