- Aromate
-
Als Aromaten (aromatische Verbindungen) oder auch Arene werden in der organischen Chemie Verbindungen bezeichnet, die einen aromatischen Ring enthalten. Aromatische Ringe sind ein zyklisches Strukturmotiv aus konjugierten Doppelbindungen und/oder freien Elektronenpaaren oder unbesetzten p-Orbitalen, das der Hückel-Regel genügt. Sie zeichnen sich durch gegenüber anderen Doppelbindungssystemen stark verminderte und veränderte Reaktivität aus. Der Begriff Aromat deutet nicht grundsätzlich auf ein besonderes Aroma dieser Substanzen hin, sondern ist historisch begründet.
Aromaten sind planare, cyclische Moleküle mit konjugierten Doppelbindungen. Sie haben, wenn sie die Aromatizitätskriterien erfüllen, besonders günstige Energieniveaus. Sie unterscheiden sich in chemischen und physikalischen Eigenschaften von den übrigen organischen Verbindungen, den Aliphaten.
Inhaltsverzeichnis
Aromatizitätskriterien
Historische Definitionen
- Aromaten sind dem Benzol verwandte Verbindungen mit oft angenehmem, aromatischem Geruch. Von diesem typischen Duft kommt die Bezeichnung Aromat (gr. aroma - Duft).
Diese Definition ist unpräzise, da subjektiv, und antiquiert, da bei Aromaten mit hoher molarer Masse oder stark polaren Substituenten oft kein Geruch wahrnehmbar ist.
- Aromaten sind mehrfach ungesättigte Verbindungen, die gegenüber der Addition an der Doppelbindung relativ reaktionsträge sind und die stattdessen relativ leicht direkt an einer Doppelbindung eine Substitution eingehen.
Diese Namensbestimmung, die eine experimentelle Unterscheidung erlaubt, war beispielsweise im 20. Jahrhundert gültig, schon bevor die Struktur- und Bindungsverhältnisse geklärt waren. Heute wird in der Regel eine allgemeinere Definition über die elektronische Struktur bevorzugt. Die angegebenen Eigenschaften – kurz: Substitution statt Addition – sind natürlich dennoch charakteristische und sehr wichtige Merkmale.
- Das Bindungssystem der Aromaten zeigt eine besondere Stabilität, die zum Beispiel durch den Vergleich der Hydrierungsenthalpie als Resonanzenergie bestimmt werden kann.
- Die Resonanzfrequenz der Wasserstoffatome im Kernresonanzexperiment ist charakteristisch. Diese äußert sich in einer starken Tieffeldverschiebung für Protonen außerhalb des aromatischen Systems und einer Hochfeldverschiebung für Protonen innerhalb des aromatischen Systems.
Definition der Aromaten
Notwendige, aber nicht hinreichende Voraussetzungen für einen Aromaten:
- Ein cyclisches Molekül, das heißt, es hat mindestens einen Ring, der in vielen Fällen ein Benzolring ist.
- Ein vollständig über den Ring konjugiertes Doppelbindungs-System.
Das sind entweder- mehrere Doppelbindungen, die bei Kohlenwasserstoffen jeweils durch genau eine Einfachbindung getrennt sind (Im Sonderfall der Arine kann auch eine Dreifachbindung auftreten.) oder
- eine oder mehrere Doppelbindungen, die durch positiv oder negativ geladene Kohlenstoffatome oder durch Heteroatome getrennt sind.
Gleichbedeutend und kürzer lautet diese Bedingung:
- alle Atome des Rings sind sp2-hybridisiert (Siehe auch: Orbital).
Ein Aromat liegt dann vor, wenn auch die folgenden Bedingungen erfüllt sind:
- Das Doppelbindungssystem ist planar; in Ausnahmefällen sind leichte Abweichungen von der Ebene gestattet. Zum Beispiel ist in einigen Cyclophanen die Benzoleinheit in einem Winkel von bis zu 30° bootförmig deformiert.
- Die Zahl der delokalisierten Elektronen muss der Hückel-Regel genügen, das heißt im konjugierten Elektronensystem müssen 2 oder 6 oder 10 oder 14... Elektronen vorliegen:
Die von Erich Hückel aufgestellte Hückel-Regel wird meist durch die Formel (4n + 2) π-Elektronen (n = 0,1,2,3...), delokalisiert über alle Ringatome des Systems, wiedergegeben. Cyclisch konjugierte π-Systeme mit 4n π-Elektronen (n = 1,2,3...) heißen Antiaromaten.
Die Grundstruktur vieler aromatischer Verbindungen ist das Benzol C6H6. (Die Hückel-Regel ist hier mit n=1 erfüllt: Benzol besitzt 6 π-Elektronen.) Das Benzol wird daher als einer der einfachsten aromatischen Kohlenwasserstoffe angesehen – insbesondere da die besonderen Eigenschaften aromatischer Verbindungen am Benzol und dessen Derivaten entdeckt wurde. Benzol ist gegenüber einem hypothetischen (das heißt nicht herstellbaren) Cyclohexatrien mit lokalisierten Doppelbindungen stabiler und damit weniger reaktiv.
Da laut Hückel-Regel auch ein planares, cyclisch konjugiertes System mit 2 π-Elektronen als Aromat gilt, sind auch Cyclopropenium-Salze Aromaten:
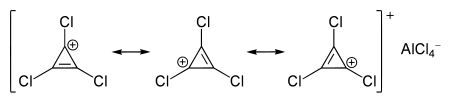
Der Cyclopropenylring ist deutlich kleiner als der Benzolring, da hier n = 0 ist, während beim Benzol n = 1 ist.
Reaktionen von Aromaten
Am wichtigsten sind Substitutionsreaktionen, beispielsweise
- Elektrophile aromatische Substitution (zum Beispiel Sulfonierung, Nitrierung, Friedel-Crafts-Alkylierung, Friedel-Crafts-Acylierung, Azokupplung, Chlorierung, Bromierung).– Für die elektrophile Zweitsubstitution am Aromaten gelten spezielle Regeln. Bereits am Aromaten vorhandene Erstsubstituenten 'dirigieren' den Zweitsubstituenten bevorzugt in eine bestimmte Position (ortho-, meta- und/oder para-ständig zum Erstsubstituenten)
- Nukleophile aromatische Substitution
- Dearomatisierung: Verlust des aromatischen Systems durch Reduktion.
Einteilung der Aromaten
Kriterien
Aromatische Systeme Fünfringe Kondensierte Fünfringe 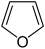
Furan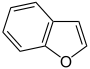
Benzofuran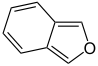
Isobenzofuran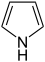
Pyrrol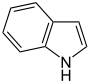
Indol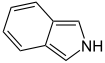
Isoindol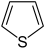
Thiophen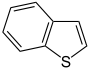
Benzothiophen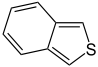
Benzo[c]thiophen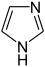
Imidazol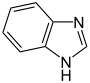
Benzimidazol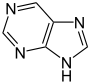
Purin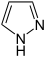
Pyrazol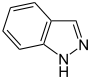
Indazol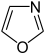
Oxazol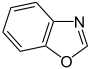
Benzoxazol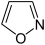
Isoxazol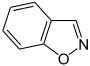
Benzisoxazol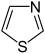
Thiazol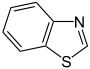
BenzothiazolSechsringe Kondensierte Sechsringe 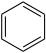
Benzol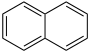
Naphthalin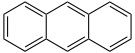
Anthracen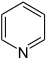
Pyridin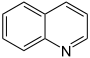
Chinolin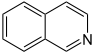
Isochinolin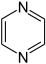
Pyrazin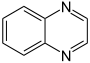
Chinoxalin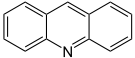
Acridin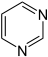
Pyrimidin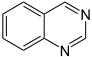
Chinazolin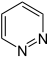
Pyridazin
CinnolinEs gibt eine gewaltige Zahl (mehrere Millionen sind bekannt) verschiedenster aromatischer Verbindungen. Sie können nach verschiedenen Kriterien in Gruppen eingeteilt werden:
- Wie alle chemischen Verbindungen, bei denen zwischen organisch (enthält Kohlenstoffatome) und anorganisch unterschieden wird, können auch die Aromaten entsprechend in organisch und anorganisch unterteilt werden. Ein anorganischer Aromat ist beispielsweise das Borazol B3N3H6, das sich formal vom Benzol C6H6 ableiten lässt, indem man die Kohlenstoffatome abwechselnd durch Stickstoffatome oder Boratome ersetzt. Allerdings ist Borazol eher auf dem Papier aromatisch denn in der Praxis: Die Elektronendichten sind stark an den Stickstoffatomen lokalisiert (anstatt über den Ring gleichmäßig verteilt) und der Ring ist stark gewellt. Auch die Reaktivität bei Angriff des Rings durch Nukleophile oder Elektrophile (im Gegensatz zum trägen Benzol) zeigt eine deutliche Bindungspolarisierung.
- Ringsysteme, die nur aus Kohlenstoffatomen bestehen, nennt man Carbocyclen. Benzol C6H6 und Naphthalin C10H8 gehören demnach zu den Carbocyclen. Heteroaromaten enthalten dagegen wie alle Heterocyclen im Ringsystem selbst andere Atome wie etwa Stickstoff, zum Beispiel im Aromaten Pyridin C5H5N. (Pyridin leitet sich formal vom Benzol ab, indem eine C–H-Atomgruppe durch N ersetzt wird.)
- Carbocyclische Aromaten (= mit Kohlenstoffatom-Aromatengerüst) können in (aromatische) Kohlenwasserstoffe und substituierte Aromaten unterteilt werden (entsprechend der Einteilung der organischen Verbindungen). Benzol C6H6 und Toluol C6H5-CH3 sind Kohlenwasserstoffe, Phenol C6H5-OH und Trinitrotoluol TNT C6H2(NO2)3(CH3) sind daraus durch Substitution abgeleitete Verbindungen.
- Eine weitere Einteilung erfolgt nach der Zahl der aromatischen Cyclen: Eine der einfachsten aromatischen Verbindungen, das Benzol, besteht aus genau einem Ring. Naphthalin C10H8 ist ein Bicyclus, es besitzt ein aromatisches π-System mit 10 π-Elektronen, welches über die beiden Ringe verteilt ist.
- Aromaten mit mehreren Ringen können eingeteilt werden in solche, bei denen die Ringe gemeinsame Atome haben (kondensierte oder anellierte Ringe), wie im Naphthalin C10H8, oder solche, mit separaten (isolierten) Ringen, beispielsweise Biphenyl C6H5-C6H5.
- Eine weitere Einteilung kann nach der Zahl der Ringatome des aromatischen Systems erfolgen. Typisch sind sechs Ringatome, etwa beim Benzol C6H6. Um einen geschlossenen Ring zu bilden, sind mindestens drei Atome nötig, und dementsprechend existieren Aromaten mit drei, vier, fünf – etwa beim C5H5− Cyclopentadien-Anion, sieben oder mehr Atomen.
- Nach der Ladung des aromatischen Systems, zum Beispiel ist das Cyclopentadien-Anion einfach negativ geladen.
Beispiele aromatischer Verbindungen
Kohlenwasserstoffe
Aromatische Kohlenwasserstoffe werden Arene genannt. Beispiele dafür sind:
- Benzol C6H6
- Toluol (Methylbenzol) C6H5-CH3
- Xylol (Dimethylbenzol) CH3-C6H4-CH3
- Mesitylen (Trimethylbenzol) C6H3(CH3)3
Kohlenwasserstoffe mit mehreren Ringen werden polyzyklische aromatische Kohlenwasserstoffe (PAK) genannt, das sind zum Beispiel:
- Naphthalin C10H8 (2 Ringe; zwei mal Sechsring)
- Azulen C10H8 (2 Ringe; Fünf-/Siebenring )
- Anthracen C14H10 (3 Ringe)
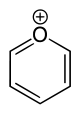
Aromatische Ionen
Das freie Elektronenpaar besetzt ein sp2-Hybridorbital des Sauerstoffs, liegt in der Ringebene und trägt damit nicht zum π-System bei (analog zur Elektronenstruktur des Pyridins).
Vom Benzol durch Substitution abgeleitete Derivate
- Phenol C6H5-OH
- Nitrobenzol C6H5-NO2
- Anilin (Aminobenzol) C6H5-NH2
- Chlorbenzol C6H5-Cl
- Hydrochinon HO-C6H4-OH
- Pikrinsäure (2,4,6-Trinitrophenol) C6H2(OH)(NO2)3
Heteroaromaten
- Furan C4H4O (Fünfring mit Sauerstoffatom)
- Thiophen C4H4S (Fünfring mit Schwefelatom)
- Pyridin C5H5N (Sechsring mit Stickstoffatom)
- Pyrrol C4H4NH (Fünfring mit Stickstoff-und Wasserstoffatom)
Antiaromaten
Antiaromatische Systeme 
Cyclobutadien
OxepinAls Antiaromaten bezeichnet man Stoffe, die die ersten drei Bedingungen eines Aromaten erfüllen (cyclisch, planar, konjugierte Doppelbindungen), statt 4n+2 π-Elektronen jedoch 4n π-Elektronen besitzen. Antiaromaten besitzen nach der Hückel-Näherung ungünstige Energieniveaus. Der einfachste Antiaromat, Cyclobutadien, kann in freier Form nicht hergestellt werden. Er ist interessanterweise in der Organometallchemie als Ligand stabil.
Cyclooctatetraen besitzt 8 π-Elektronen. Es liegt jedoch nicht planar vor, sodass die Doppelbindungen nicht konjugiert sind. Die Hückel-Regel kann also nicht angewandt werden. Damit ist 1,3,5,7-Cyclooctatetraen ein Nichtaromat.
Antiaromaten dürfen nicht mit den nicht-aromatischen Verbindungen, den Aliphaten, verwechselt werden.
Möbius-Aromaten
Die 1964 von Edgar Heilbronner vorhergesagte Möbius-Aromatizität[1] setzt voraus, dass in einem cyclisch-konjugierten System die besetzten pπ-Orbitale als Möbiusband angeordnet sind, d. h. mit einer 180°-Drehung. Zusätzlich sind die π –Orbitale mit 4n Elektronen besetzt (wobei n hier eine natürliche Zahl ist). Möbius-Aromaten sind durch die Verdrehung chiral. Ob ein 2003 von Herges et al. synthetisiertes Molekül[2] wirklich einen Möbius-Aromaten darstellt oder nur die nötige Topologie besitzt, wird noch kontrovers diskutiert.[3]
Siehe auch
Weblinks
- Hückel-Regel (pdf)
- Vorlesungsskript (pdf)
Quellen
- ↑ Edgar Heilbronner, Tetrahedron Lett. 1964, 1923.
- ↑ Synthesis of a Möbius aromatic hydrocarbon D. Ajami, O. Oeckler, A. Simon, R. Herges, Nature; 2003; 426 pp 819.
- ↑ Investigation of a Putative Möbius Aromatic Hydrocarbon. The Effect of Benzannelation on Möbius [4 n]Annulene Aromaticity Claire Castro, Zhongfang Chen, Chaitanya S. Wannere, Haijun Jiao, William L. Karney, Michael Mauksch, Ralph Puchta, Nico J. R. van Eikema Hommes, Paul von R. Schleyer J. Am. Chem. Soc. 127 (2005) 2425–2432 Abstract.
Wikimedia Foundation.