- Neupro
-
Strukturformel 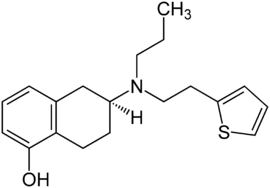
Allgemeines Freiname Rotigotin Andere Namen (−)-(S)-6-[Propyl(2-thiophen-2-ylethyl) amino]-5,6,7,8-tetrahydronaphthalen- 1-ol
Summenformel C19H25NOS CAS-Nummer 99755-59-6 PubChem 57537 ATC-Code N04BC09
Arzneistoffangaben Wirkstoffklasse Wirkmechanismus Fertigpräparate Verschreibungspflichtig: Ja Eigenschaften Molare Masse 315,47 g·mol−1 Sicherheitshinweise Gefahrstoffkennzeichnung
unbekanntR- und S-Sätze R: ? S: ? Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Rotigotin (Handelsname: Neupro®; Hersteller: Schwarz Pharma) ist ein Arzneistoff aus der Gruppe der non-ergolinen Dopaminagonisten, der in der Behandlung der Parkinson-Erkrankung eingesetzt wird.
Inhaltsverzeichnis
Klinische Angaben
Rotigotin wird zurzeit als Monotherapie (d.h. ohne Levodopa) zur symptomatischen Behandlung der Parkinson-Erkrankung im Frühstadium und als Kombinationstherapie mit Levodopa in späteren Stadien der Erkrankung eingesetzt. Rotigotin wird in Form eines transdermalen Pflasters einmal täglich angewendet.
Wirksamkeit und Verträglichkeit von Rotigotin sind in einer Reihe von klinischen Studien gezeigt worden.[3][4] Motorische Leistungen und Aktivitäten des täglichen Lebens der Parkinson-Patienten verbesserten sich signifikant unter einer Behandlung mit Rotigotin.
Aufgrund seiner transdermalen Applikation wird der Wirkstoff Rotigotin kontinuierlich über 24 Stunden freigesetzt. Durch diese kontinuierliche Stimulation der Dopaminrezeptoren im Gehirn und dem damit verbundenen gleich bleibenden Plasmaspiegel wird nicht nur die Beweglichkeit der Patienten verbessert, sondern auch das Auftreten von Dyskinesien (Gehstöhrungen) reduziert. Bisher war kontinuierliche dopaminerge Stimulation nur mit entsprechenden Pumpen möglich. Das Parkinson-Pflaster ist eine einfache, leicht anzuwendende neue Alternative. Die transdermale Applikation gewährleistet eine gute Steuerbarkeit, falls die Dosis aufgrund von Nebenwirkungen reduziert werden muss, denn das Pflaster kann bei Bedarf problemlos abgenommen werden. Außerdem ist die Wirkung des Pflasters unabhängig von Mahlzeiten, Gastroparesen oder Resorptionsstörungen.
Nebenwirkungen
Unter einer Behandlung mit Rotigotin treten typische dopaminerge Nebenwirkungen wie Übelkeit, Erbrechen, Schwindel oder Schläfrigkeit auf. In machen Fällen kommt es außerdem zu Hautreizungen unter dem Pflaster wie Rötung und Juckreiz. Zwischen einem Promille und einem Prozent der mit Rotigotin behandelten Patienten klagt über chronische Hustenbildung.
Handelsnamen und Darreichungsformen
Wichtiger Hinweis: Handelsnamen und Darreichungsformen von Arzneistoffen unterliegen keiner Standardisierung. Sie können sich daher in einzelnen Ländern unterscheiden. Das hautfarbene Pflaster ist in vier verschiedenen Größen 10, 20, 30, 40 cm² mit den Dosierungen 2 mg/24 h, 4 mg/24 h, 6 mg/24 h und 8 mg/24 h verfügbar. Der zugelassene Dosisbereich ist 2 mg/24 h bis zu 16 mg/24 h.
Geschichtliches
Rotigotin wurde in den 1980er Jahren an der Universität Groningen synthetisiert und 1985 erstmals als N-0437 beschrieben.[5] Die Entwicklungs- und Vermarktungsrechte wurden 1998/99 von der US-amerikanischen Firma Aderis an die deutsche Firma Schwarz übertragen.
Das Arzneimittel wurde im Februar 2006 in der EU für die Behandlung des Frühstadiums der Parkinson-Erkrankung zugelassen. Im Januar 2007 folgte die EU-Zulassung für die späteren Stadien der Erkrankung und im Mai 2007 die US-Zulassung für das Frühstadium.
Aufgrund technischer Probleme bei der Herstellung des Pflasters erfolgte im März 2008 ein Rückruf vom US-amerikanischen Markt[6] während die Versorgung der Patienten in der EU mittels Kühlkette erfolgt.[7],[8]
Im April 2008 empfahl der europäische Ausschuss für Humanarzneimittel die Zulassung von Rotigotin zur Behandlung des Restless Legs Syndroms.
Weblinks
Einzelnachweise
- ↑ ABDA-Datenbank (Stand: 24.08.2008) der DIMDI
- ↑ Austria-Codex (Stand: 24.08.2008)
- ↑ Parkinson Study Group. A Controlled Trial of Rotigotine Monotherapy in Early Parkinson’s Disease. Arch Neurol 2003;60:1721-8. PMID 14676046
- ↑ Watts RL, Jankovic J, Waters C et al. Randomized, blind, controlled trial of transdermal rotigotine in early Parkinson disease. Neurology 2007;68:272-6. PMID 17202432
- ↑ Horn AS, Tepper P, Van der Weide J et al. Synthesis and radioreceptor binding activity of N-0437, a new, extremely potent and selective D2 dopamine receptor agonist. Pharm Weekbl Sci 1985;7:208-11. PMID 2933633
- ↑ Presseerklärung UCB S.A. vom 20. März 2008: UCB advises US-physicians to down-titrate patients on Neupro® in view of out-of-stock situation in the US zugegriffen am 2. August 2008
- ↑ Presseerklärung UCB S.A. vom 4. Juni 2008: UCB to implement full cold-chain for Neupro® zugegriffen am 2. August 2008
- ↑ UCB GmbH: Rote-Hand-Brief zu Neupro® vom 12. Juni 2008 zugegriffen am 2. August 2008
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.
