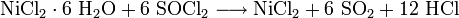- NiCl2
-
Strukturformel 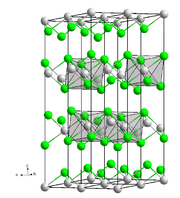
__ Ni2+ __ Cl- Allgemeines Name Nickel(II)-chlorid Andere Namen - Nickeldichlorid
- Nickelchlorid
Summenformel NiCl2 (wasserfrei)
NiCl2 · 6 H2O (Hexahydrat)CAS-Nummer 7718-54-9 (wasserfrei)
7791-20-0 (Hexahydrat)Kurzbeschreibung gelbe Kristalle (wasserfrei)
grüne Kristalle (Hexahydrat)Eigenschaften Molare Masse 129,62 g/mol (wasserfrei)
237,70 g/mol (Hexahydrat)Aggregatzustand fest
Dichte Schmelzpunkt Dampfdruck Löslichkeit sehr gut in Wasser (2540 g/l, Hexahydrat bei 20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 49-61-23/25-38-42/43-48/23-68-50/53 S: 53-45-60-61 MAK keine Einstufung, da krebserzeugend[1]
WGK 3[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Nickel(II)-chlorid, NiCl2, ist das Nickel-Salz der Salzsäure.
Es bildet gelbe, in Wasser und Ethanol gut lösliche Kristalle. Neben der wasserfreien Form (NiCl2, Anhydrat), existiert das wasserhaltige Nickel(II)-chlorid-hexahydrat, NiCl2 · 6 H2O, welches grüne Kristalle ausbildet. Weiterhin ist das Nickel(II)-chlorid-dihydrat, NiCl2 · 2 H2O, bekannt.
Inhaltsverzeichnis
Eigenschaften
Das wasserfreie Nickel(II)-chlorid-Anhydrat ist ein stark hygroskopisches Salz. Es hat eine CdCl2-Struktur.[3] Im Gegensatz dazu besitzt Nickel(II)-chlorid-hexahydrat eine ähnliche Struktur wie auch Cobalt(II)-chlorid-Hexahydrat und besteht aus einzelnen trans-[NiCl2(H2O)4] Molekülen mit schwacher Bindung zu den benachbarten Wassermolekülen. Dabei sind nur vier der sechs Wasser-Moleküle aus der Formel mit dem die Nickel verbunden. Die restlichen zwei sind Kristallwasser.[3] Nickel(II)-chlorid-hexahydrat besitzt einen Nickelgehalt von mindestens 23–24,6% und kann neben Nickel noch weitere Metalle, wie zum Beispiel Eisen, Cobalt oder Calcium, enthalten. Nickel(II)-chlorid ist durch seine Wasserlöslichkeit und der damit leichten Resorbierbarkeit giftig. Die Kanzerogenität (Krebsauslösung) gilt ebenfalls als erwiesen. Außerdem besteht bei allen Nickelverbindungen die Gefahr der Sensibilisierung (Allergisierung).
Herstellung
Das grüne Nickel(II)-chlorid-hexahydrat NiCl2 · 6 H2O kristallisiert durch Umsetzung von Salzsäure (HCl) mit Nickelhydroxid Ni(OH)2 aus wässrigen Lösungen aus. Es bildet dabei typischerweise monokline Prismen als Kristallform.
Gelbes, wasserfreies NiCl2 lässt sich durch Trocknung im Chlorwasserstoff-Strom bei einer Temperatur von ca. 140 °C oder Erhitzung in Thionylchlorid aus dem Hexahydrat gewinnen.Die Entwässerung wird durch den Wechsel der Farbe von grün nach gelb angezeigt. Die Herstellung der wasserfreien Form kann auch aus elementarem Nickel durch längere Einwirkung von HCl bei Temperaturen oberhalb 550 °C erfolgen.
Verwendung
Es dient als Farbstoff in der Keramik, in der galvanischen Vernickelung und zur Herstellung von Nickelkatalysatoren. Nickel(II)-chlorid ist weiterhin ein möglicher Nickelelektrolyt zur Vernickelung metallischer Oberflächen und ein Beizmittel in der Färberei. Die wasserfreie Form wird als Absorber für Ammoniak in Gasmaskenfiltern eingesetzt.
Quellen
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 7718-54-9 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 12.01.08 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7718-54-9 im European chemical Substances Information System ESIS
- ↑ a b , Wells, A. F. Structural Inorganic Chemistry, Oxford Press, Oxford, United Kingdom, 1984.
Wikimedia Foundation.

-chlorid.JPG)