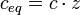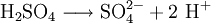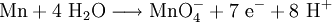- Normallösung
-
Die Äquivalentkonzentration, (Formelzeichen: ceq), veraltet "Normalität", (Einheitenzeichen: N), ist eine Konzentrationsangabe in der Chemie; sie ist eine spezielle Stoffmengenkonzentration, bei der die zu Grunde gelegten Teilchen i. a. nicht ganze Atome, Moleküle oder Ionen, sondern gedachte Bruchteile 1/z solcher Teilchen sind. Hierbei ist z die stöchiometrische Wertigkeit, die auch Äquivalentzahl genannt wird. Im Falle z = 3 ist also die Äquivalentkonzentration 3-mal so groß wie die Stoffmengenkonzentration, weil sozusagen jedes ganze Teilchen z-mal gezählt wird. Die Bruchteile 1/z nennt man auch Äquivalentteilchen oder Äquivalente. ceq ist ein Maß dafür, wie viele Äquivalentteilchen eines Stoffes sich in einem bestimmten Volumen der Lösung befinden.
Besonders wichtig ist die Äquivalentkonzentration bei Neutralisationsreaktionen, Redoxreaktionen in der Maßanalyse und bei Ionenreaktionen.
Bei einer Redoxreaktion kann ein Manganion von MnO4- 5 Elektronen aufnehmen, ein Chloridion aber nur ein Elektron abgeben. Die molare Masse des Kaliumpermanganats muss durch 5 geteilt werden, dann die Menge in genau einem Liter destilliertem Wasser gelöst werden, um die Äquivalentkonzentration dieses Oxidationsmittels von 1 neq (Mol Elektronenaufnahme)/Liter zu erhalten. 1 neq(=1 Val) Elektronenaufnahme, entspricht also 1/5 Molmasse KMnO4 und dies wird beschrieben als: neq (KMnO4)= n (1/5 KMnO4).
Bei Säure/Base-Titrationen gibt es Säuren mit ein, zwei (z.B. Schwefelsäure) oder drei Protonen (z.B. Phosphorsäure). Werden diese Säuren mit Natronlauge titriert braucht man entsprechend den Äquivalentzahlen der Säure ein, zwei oder drei Teile Natronlauge, um eine Säure zu neutralisieren. Daher wird bei Säure/Base Titrationen das Molgewicht durch die Zahl der abgebbaren oder aufnehmbaren Protonen dividiert und diese Substanzmenge in einem Liter dest. Wasser gelöst, um die Äquivalentkonzentration von 1 Mol neq Protonen zu erhalten. Genau dann gilt: neq (H2SO4)= neq (NaOH)
Inhaltsverzeichnis
Definition
Die Äquivalentkonzentration ist definiert durch die Gleichung:
Hierbei ist ceq die Äquivalentkonzentration und c die Stoffmengenkonzentration der Lösung sowie z die stöchiometrische Wertigkeit, auch Äquivalentzahl.
Die stöchiometrische Wertigkeit - und somit auch die Äquivalentkonzentration einer bestimmten Lösung - kann von der chemischen Reaktion, also der Verwendung der Lösung abhängig sein, ohne dass diese selbst sich ändert. Ferner ist die Äquivalentkonzentration temperaturabhängig.
Übliche Einheit ist Mol/Liter.
Lösungen mit ceq = 1 mol/L wurden früher als "Normallösungen" bezeichnet. Man sprach auch von 0,1N-Lösungen, wenn ceq = 0,1 mol/L betrug, u. s. w.
Eine andere Möglichkeit der Definition ist über die Anzahl der in einem Liter einer Lösung gelösten Äquivalente bzw. Val.
Die Normalität ist dann definiert durch die Gleichung:
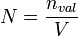 .
.
Hierbei ist N die Normalität, nval die Menge an Äquivalenten und V das Volumen.
Beispiele
Salzlösungen
Natriumcarbonat (Na2CO3) besteht aus zwei Natrium-Ionen (Na+) und einem Carbonat-Ion. Somit entspricht eine 1 molare (M) Natriumcarbonat-Lösung einer 2 normalen (N) Natriumcarbonat-Lösung bezogen auf die Natrium-Ionen (z = 2).
Säure-Base-Reaktionen
Bei Säure-Base-Reaktionen sind Äquivalentteilchen Protonen (H+) in sauren Lösungen bzw. Hydroxid-Ionen (OH−) in basischen Lösungen. An ein Sulfation (SO42−) können sich zum Beispiel zwei Protonen anlagern, was der Wertigkeit des Säure-Ions entspricht. Folglich sind in der Lösung doppelt so viele Äquivalentteilchen (hier Protonen) enthalten, wie Moleküle des Stoffes selbst.
Redoxreaktionen
Bei Redoxreaktionen hingegen ist das Äquivalent die Stoffmenge des Oxidations- bzw. Reduktionsmittels, die exakt 1 mol Elektronen annehmen bzw. abgeben kann. Ein Beispiel:
Bei dieser Reaktion ist Mangan das Reduktionsmittel und 1 mol Mangan gibt 7 mol Elektronen ab. Es gibt folglich 1/7 mol Mangan genau 1 mol Elektronen ab. Das Äquivalentteilchen ist hier 1/7 Mn.
Siehe auch
Quellen
- Hans R. Christen, Gerd Meyer: Grundlagen der Allgemeinen und Anorganischen Chemie. Salle + Sauerländer, 1997, ISBN 3793554937
- Frank H. Stepheson: Mathematik im Labor. Elsevier Verlag, München 2004, ISBN 3-8274-1596-9
Wikimedia Foundation.