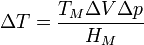- Normalschmelztemperatur
-
Schmelzpunkt Θ einiger Substanzen bei 1013 Hektopascal Material Θ[°C] [K] Helium −272,2 0,955 Wasserstoff −259 14 Ethanol (C2H5OH) −114 159 Quecksilber −38,36 234,795 Wasser 0 273,155 Benzol 5,5 278,7 Naphthalin 80 353 Schwefel (rhombisch) 113 386 Schwefel (monoklin) 119 392 Zinn 231 504 Blei 327,4 600,6 Zink 419,5 692,7 Aluminium 660,32 933,48 Kochsalz 801 1.074 Silber 960,8 1.234,0 Gold 1.064 1.337 Kupfer 1.084 1.357 Eisen 1.536 1.809 Platin 1.773,5 2.046,7 Wolfram 3.422 3.695 Diamant 3.547 3.820 Hafniumcarbid 3.890 4.163 Tantalcarbid 3.942 4.215 Tantalhafniumcarbid 4.215 4.488 Als Schmelztemperatur bezeichnet man die Temperatur, bei der ein Stoff schmilzt, das heißt vom festen in den flüssigen Aggregatzustand übergeht. Die Schmelztemperatur ist abhängig vom Stoff, im Gegensatz zur Siedetemperatur aber nur sehr wenig vom Druck (Schmelzdruck). Schmelztemperatur und Druck werden zusammen als Schmelzpunkt bezeichnet, wobei dieser den Zustand eines Reinstoffes beschreibt und Teil der Schmelzkurve im Phasendiagramm des Stoffes ist.
Für reine Elemente ist der Schmelzpunkt identisch mit dem Gefrierpunkt und bleibt während des gesamten Schmelzvorganges konstant. Durch Verunreinigungen bzw. bei Gemischen wird die Schmelztemperatur in der Regel erniedrigt (Schmelzpunkterniedrigung), außerdem kann die Temperatur während des Schmelzvorganges steigen, wodurch man es mit einem Schmelz-Bereich zu tun hat. Falls die Gefrierpunktstemperatur unterhalb der Schmelzpunkttemperatur liegt, spricht man von einer thermischen Hysterese. Dies ist zum Beispiel bei reinem Wasser der Fall; ohne Nukleationskeime und unter einem Druck von 1 bar gefriert Wasser bei ca. -40°C und schmilzt bei ca. 0°C. Bei amorphen Werkstoffen wie z. B. Gläsern und einigen Kunststoffen spricht man von der Übergangstemperatur. Auch die Bestimmung einer Erweichungstemperatur ist möglich. Manche Stoffe können nicht schmelzen, weil sie vorher chemisch zerfallen, und andere können bei Normalbedingungen nur sublimieren.
Die Schmelztemperatur zählt mit der Dichte, Risszähigkeit, Festigkeit, Duktilität, Härte, und der Steifigkeit zu den Werkstoffeigenschaften eines Werkstoffes.
Inhaltsverzeichnis
Druckabhängigkeit
Der Schmelzpunkt hängt zwar vom Druck ab, allerdings nur geringfügig: Um den Schmelzpunkt um lediglich 1 K zu ändern, muss der Druck durchschnittlich um etwa 100 Bar erhöht werden. Daraus folgt, dass sich Änderungen des Atmosphärendrucks – die merkliche Änderungen des Siedepunkts bewirken können – praktisch nicht auf den Schmelzpunkt auswirken.
Für das Schmelzen gilt wie für andere Phasenumwandlungen die Clausius-Clapeyronsche Gleichung, die in guter Näherung für das Schmelzen bei verschiedenen Drücken folgende Temperaturänderung ΔT ergibt:
Dabei ist TM der Schmelzpunkt, ΔV die Volumenänderung beim Schmelzen, Δp die Differenz der betrachteten Drücke, und HM die Schmelzenthalpie. Da aber die Volumenänderungen ΔV beim Schmelzen relativ klein sind, ist auch die Druckabhängigkeit des Schmelzpunktes relativ klein. Beispielsweise ändert sich bei einer Erhöhung des Drucks um 100 Bar der Schmelzpunkt von Eis um −0,76 K – Eis schmilzt also unter Druck leichter – , während sich der Schmelzpunkt von Tetrachlorkohlenstoff um +3,7 K erhöht. Die Tatsache, dass sich der Schmelzpunkt von Eis oder beispielsweise auch von Bismut bei Druckerhöhung erniedrigt, folgt daraus, dass ihr Volumen beim Schmelzen verringert wird: Dann ist in der obigen Gleichung ΔV und ΔT negativ.
Bedeutung
Der Schmelzpunkt von Wasser hat große Bedeutung in der Biologie und für das Wetter.
Die Schmelzpunkterniedrigung (Kryoskopie) durch gelöste Substanzen ist ein Grund, warum Eis durch Salz geschmolzen werden kann.
Analytik
Die Bestimmung des Schmelzpunkts einer Substanz ist auch von großer Bedeutung in der qualitativen Analytik, einschließlich der Identitätsprüfung, da viele Substanzen über ihren Schmelzpunkt identifiziert werden können. Die Reinheit von Stoffen kann qualitativ ebenfalls über den Schmelzpunkt gemessen werden. Verunreinigungen haben niedrigere Schmelzpunkte zur Folge. Flüssige Substanzen oder solche mit niedrigem Schmelzpunkt werden dazu in leicht kristallisierende Derivate umgewandelt: Alkohole können beispielsweise durch die Messung der Schmelzpunkte ihrer Ester der 4-Nitrobenzoesäure oder der 3,5-Dinitrobenzoesäure identifiziert werden. Hierzu wird die zu analysierende Substanz in Gegenwart geringer Mengen Schwefelsäure umgesetzt. Die Schmelzpunkte dieser Derivate sind in der Regel scharf.
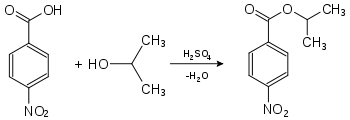
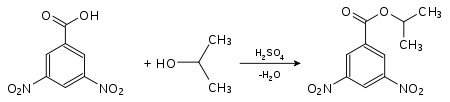
Nachweis von Isopropanol als Derivat der 4-Nitrobenzoesäure:
4-Nitrobenzoesäure-2-propylester (Smp.: 100,5 °C[1])Nachweis von Isopropanol als Derivat der 3,5-Dinitrobenzoesäure:
3,5-Dinitrobenzoesäure-2-propylester (Smp.: 123 °C[1])Die Derivate der 3,5-Dinitrobenzoesäure besitzen in der Regel höhere Schmelzpunkte als die der 4-Nitrobenzoesäure.[1] Sie werden dann bevorzugt gewählt, wenn der Schmelzpunkt mit der 4-Nitrobenzoesäure zu niedrig ist und keine genaue Bestimmung mehr möglich wird.
Bestimmung
Eine ungefähre Messung ist natürlich einfach mit einem Thermometer durch Aufschmelzen der Probe und Ablesen der Schmelztemperatur möglich.
Für die exakte Messung des Schmelzpunktes stehen unterschiedliche Methoden zur Verfügung:
- Apparatur nach Thiele
- Apparatur nach Dr. Linström
- Heiztischapparatur nach Kofler – Kofler Heizbank, Tottoli
- Dynamische Differenzkalorimetrie (DSC)
Einzelnachweise
- ↑ a b c CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
Siehe auch
Phasendiagramm, molare Schmelzpunkterniedrigung, Siedetemperatur
Wikimedia Foundation.