- 1,3-Dihydroxypropan-2-on
-
Strukturformel 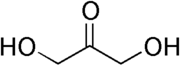
Allgemeines Name Dihydroxyaceton Andere Namen - 1,3-Dihydroxypropan-2-on
- Propan-1,3-diol-2-on
- Glyceron
- DHA
Summenformel C3H6O3 CAS-Nummer 96-26-4 Kurzbeschreibung feste, weiße und hygroskopische Kristalle Eigenschaften Molare Masse 90,08 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit gut in Wasser (>250 g/l bei 20 °C)[1], löslich in Ethanol und Dimethylformamid
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze WGK 1[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Dihydroxyaceton (abgekürzt DHA, Glyceron) ist ein einfach gebautes Kohlenhydrat mit der Summenformel C3H6O3. Da Dihydroxyaceton kein Stereozentrum aufweist, gilt es eigentlich nicht als Monosaccharid. Es ist jedoch wesentlich am Kohlenhydratstoffwechsel beteiligt. DHA ist der wesentliche Inhaltsstoff von Selbstbräuner und reagiert mit Eiweißen in der Hornschicht - der obersten Hautschicht, die sich dabei bräunlich einfärbt.
Inhaltsverzeichnis
Chemische Eigenschaften
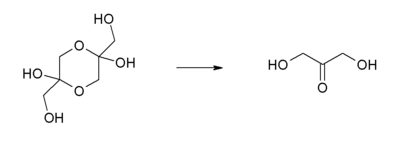
Dihydroxyaceton ist ein weißes hygroskopisches Pulver mit charakteristischem Duft und süßem Geschmack. Es gehört zur Gruppe der Zucker und innerhalb dieser, wegen der drei C-Atome aus denen das Molekül aufgebaut ist, zu den Triosen. Als einfachste denkbare Ketose besitzt das Molekül kein Chiralitätszentrum und ist optisch inaktiv. Dihydroxyaceton liegt im festen Zustand gewöhnlich als Dimer vor, das sich nach Lösung in Wasser schnell in das Monomer spaltet. Diese Reaktion verläuft nach einem Zeitgesetz erster Ordnung. Die Halbwertszeit beträgt bei Raumtemperatur 20,4 min.[2]
Herstellung
Dihydroxyaceton kann, ähnlich dem Glycerinaldehyd, durch Oxidation von Glycerin mit milden Oxidationsmitteln, wie verdünnter Wasserstoffperoxid-Lösung, in Anwesenheit von Eisensalzen als Katalysator, hergestellt werden. Die Großtechnische Herstellung erfolgt biotechnologisch durch die mikrobielle Fermentation von Glycerin durch Gluconobacter oxydans in einer Größenordnung von etwa 2.000 t pro Jahr weltweit. Eine Alternative zu dieser relativ aufwendigen Technik ist die neu entwickelte anodische Oxydation in Anwesenheit des Katalysators 2,2,6,6-Tetramethylpiperidin-1-oxyd (TEMPO).[3]
Biologische Bedeutung
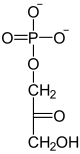
Von besonderer Bedeutung in der Biochemie ist ein Phosphorsäure-Ester des Dihydroxyacetons, das Dihydroxyacetonphosphat (hier als Anion abgebildet, wie es gewöhnlich unter physiologischen Bedingungen auftritt).
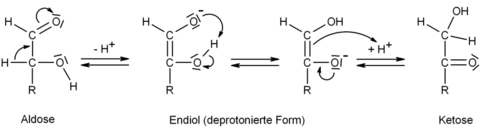
Seine Bedeutung in der Stoffwechselphysiologie liegt darin, dass es zum wichtigen Glycerinaldehyd-3-phosphat isomer ist. Die Umwandlung ineinander erfolgt basen-katalysiert über die Lobry-de-Bruyn-Alberda-van-Ekenstein-Umlagerung. In folgender Abbildung steht der Rest -R für die Gruppe -CH2-OH:
Wie auch ihre Phosphorsäureester sind auch Dihydroxyaceton und Glycerinaldehyd zueinander isomer. Sie stehen ebenfalls durch die oben aufgeführte Umlagerung in chemischen Gleichgewicht. In der Zelle werden diese Gleichgewichtsreaktionen durch bestimmte Enzyme katalysiert.
Einzelnachweise
- ↑ a b c d [1] Sicherheitsdatenblatt
- ↑ Davis, L.: The structure of dihydroxyacetone in solution in: Bioorg. Chem. 2 (1973) 197-201 Abstract
- ↑ Mario Pagliaro, Rosaria Ciriminna, Hiroshi Kimura, Michele Rossi, Christina Della Pina: Von Glycerin zu höherwertigen Produkten. Angewandte Chemie 119, 2007; S. 4516-4522.
Wikimedia Foundation.