- Octenol
-
Strukturformel 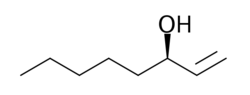
Allgemeines Name 1-Octen-3-ol Andere Namen - Vinylhexanol
- Amylvinylcarbinol
Summenformel C8H16O CAS-Nummer 3391-86-4 (Racemat)
3687-48-7 (R-(−))PubChem 18827 Kurzbeschreibung farblose Flüssigkeit mit erdig-muffigem Geruch Eigenschaften Molare Masse 128,21 g·mol−1 Aggregatzustand flüssig
Dichte 0,835 bei 20 °C [1]
Schmelzpunkt −49 °C [1]
Siedepunkt 175 °C [1]
Dampfdruck 1 mbar bei 20 °C [1]
Löslichkeit schlecht in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Gesundheits-
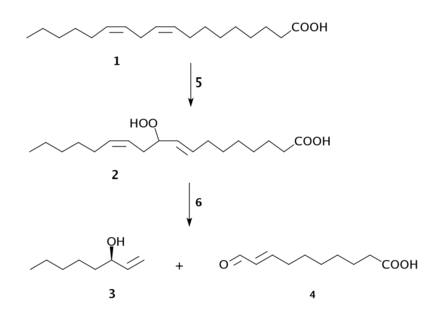
schädlich(Xn) R- und S-Sätze R: 22-36/38 S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 1-Octen-3-ol (kurz Octenol) ist eine chemische Verbindung. Im Reinzustand ist es eine farblose Flüssigkeit mit muffigem Geruch, die schwer entzündlich ist und mit Luft explosive Gemische bilden kann. Es gehört zu den Alkoholen, speziell zu den Allylalkoholen, und ist als Stoffwechselprodukt in der Natur weit verbreitet. Verwendet wird es als Lockstoff für Mücken und als Parfümbestandteil. Von den zwei Stereoisomeren ist hierbei nur das R-(−)-1-Octen-3-ol wirksam. Meist wird jedoch das technisch leichter synthetisierbare Racemat eingesetzt. Der Geschmack des Octenols ist in Nahrungsmitteln noch bis in den ppb-Bereich wahrnehmbar.[2]
Inhaltsverzeichnis
Vorkommen
Octenol ist der geschmacksbestimmende Stoff in vielen Speisepilzen. Insbesondere entsteht es im Moment des Anschneidens des Pilzfleisches. Es ist der Hauptbestandteil im ätherischen Öl von Rhododendron und bestimmt den Geschmack der Kartoffelknolle. In nicht geringen Mengen enthalten ist es weiterhin in wilder Bergamotte, Oregano und Westindischem Lorbeer. Es wirkt gegen den Befall mit Schimmelpilzen wie Penicillium oder Aspergillus und wird vermutlich aus diesem Grund als Sekundärstoff von Pilzen und Pflanzen produziert.[3]
Octenol ist Stoffwechselprodukt vieler Mikroorganismen wie beispielsweise des Schimmelpilzes Penicillium. Es ist eine der Substanzen, die den muffigen Geruch schimmliger Wohnungen verursachen, und bleibt noch längere Zeit nach erfolgter Schimmelbekämpfung wahrnehmbar. Auch schimmeliges Gemüse und alte Bücher verdanken ihr Aroma teilweise dem Octenol.
Octenol ist mitverantwortlich für viele Nahrungsmittelaromen wie z. B. den Geruch und Geschmack von Blauschimmelkäse und Camembert, oder den Korkton des Weines.[4][5][6]
Rolle im Insektenstoffwechsel
Octenol ist neben 4-Hydroxy-4-methyl-2-pentanon, 1-Hepten-3-on und 3-Octanon einer derjenigen geruchsintensiven Stoffe, die, von Pflanzen und Pilzen ausgehend, Insektenweibchen anlocken und zur Eiablage veranlassen. 40 Prozent der olfaktorischen Zellen der Tsetsefliege sprechen auf Octenol an.[7][8][9]
Herstellung und Biosynthese
Chemisch ist die Herstellung von Octenol über zwei Pfade möglich:
- durch Grignard-Reaktion von Acrolein mit Amyljodid in 65 Prozent Ausbeute
- durch selektive Reduktion von 1-Octen-3-on in 90 Prozent Ausbeute[10]
Biochemisch wird R-Octenol durch Peroxidation von Linolsäure, katalysiert von einer Lipoxygenase, und anschließende Spaltung des Hydroperoxids, mithilfe einer Hydroperoxidlyase, gebildet. Diese Reaktion findet ebenso im Käse statt und wird biotechnologisch zur Herstellung des R-Enantiomers genutzt.[11][6]
Verwendung
Octenol wird als Lockstoff für Tsetsefliegen, Mücken und Moskitos in professionellen Lockstofffallen verwendet. In manchen Parfüms ist es bis zu 1 Prozent enthalten.[12][13]
Gefährlichkeit
Octenoldämpfe wurden als ungiftig eingestuft; für geschlucktes Octenol existiert eine LD50 von 340 mg/kg und auf der Haut eine LD50 von 3300 mg/kg. Es gilt in großen Mengen als augenreizend.[13]
Einzelnachweise
- ↑ a b c d e Eintrag zu CAS-Nr. 3391-86-4 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 19. November 2007 (JavaScript erforderlich).
- ↑ M. J. Saxby: Food Taints and Off-Flavours., 2. Aufl., Springer 1995, ISBN 978-0-7514-0263-6, S. 210–212.
- ↑ D. O. Okull: Antifungal activity of 10-oxo-trans-8-decenoic acid and 1-octen-3-ol against Penicillium expansum in potato dextrose agar medium. J. Food Prot. 66/8/2003. S. 1503–1505; PMID 12929847.
- ↑ L. Moio et al.: Odour-impact compounds of Gorgonzola cheese. J. Dairy Res. 67/2/2000. S. 273–285; PMID 10840681.
- ↑ O. Ezquerro O und M. T. Tena: Determination of odour-causing volatile organic compounds in cork stoppers by multiple headspace solid-phase microextraction. J. Chromatogr. A 1068/2/2005. S. 201–208; PMID 15830925.
- ↑ a b W. Schwab und P. Schreier: Enzymic Formation of Flavor Volatiles from Lipids. in H. W. Gardner und T. M. Kuo: Lipid Biotechnology., CRC Press, 2002, ISBN 0-8247-0619-6.
- ↑ S. P. Gouinguené und E. Städler: Oviposition in Delia platura (Diptera, Anthomyiidae): the role of volatile and contact cues of bean. J. Chem. Ecol. 32/7/2006 S. 1399–1413; PMID 16718565.
- ↑ R. B. Barrozo und C. R. Lazzari: The response of the blood-sucking bug Triatoma infestans to carbon dioxide and other host odours. Chem. Senses. 29/4/2004. S. 319–329; PMID 15150145.
- ↑ Z. Syed und P. M. Guerin: Tsetse flies are attracted to the invasive plant Lantana camara. J. Insect. Physiol. 50/1/2004. S. 43–50; PMID 15037092.
- ↑ S. Wnuk et al.: Synthesis and analysis of 1-octen-3-ol, the main flavour component of mushrooms. Nahrung 27/5/1983 S. 479–486; PMID 6684212.
- ↑ K. Matsui et al.: Linoleic acid 10-hydroperoxide as an intermediate during formation of 1-octen-3-ol from linoleic acid in Lentinus decadetes. Biosci Biotechnol Biochem. 67/10/2003 S. 2280–2282; PMID 14586122.
- ↑ W. A. Qualls und G. R. Mullen: Evaluation of the Mosquito Magnet Pro trap with and without 1-octen-3-ol for collecting Aedes albopictus and other urban mosquitoes. J Am Mosq Control Assoc 23/2/2007 S. 131–136; PMID 17847844.
- ↑ a b U.S. Environmental Protection Agency: Octenol Fact Sheet: 1-Octen-3-ol (069037) & R-(−)-1-Octen-3-ol (069038) Fact Sheet. 07/05/07.
Wikimedia Foundation.