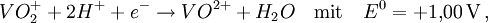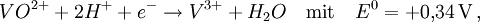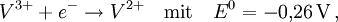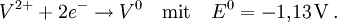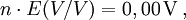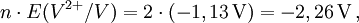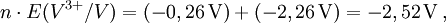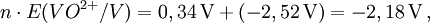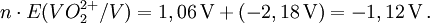- Oxidationszustandsdiagramm
-
 Frost-Diagramm von Stickstoff
Frost-Diagramm von StickstoffFrost-Diagramme (auch: Frostdiagramme) sind eine grafische Darstellung von Reduktionspotentialen von Halbreaktionen – jeweils für die verschiedenen Oxidationsstufen eines Elements. Es wird ein kartesisches Koordinatensystem verwendet, wobei auf der Abszisse die Oxidationszahl steht und auf der Ordinate üblicherweise
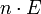 -Werte der Halbreaktion einer Oxidationsstufe zur Oxidationsstufe 0 (z. B.:
-Werte der Halbreaktion einer Oxidationsstufe zur Oxidationsstufe 0 (z. B.: 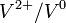 ). Der Wert
). Der Wert 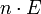 ist direkt proportional zur freien Enthalpie G nach:
ist direkt proportional zur freien Enthalpie G nach:- wobei n die Zahl der übertragenen Elektronen und F die Faraday-Konstante
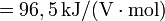 sind.
sind.
Es finden sich auch Frost-Diagramme bei welchen freie Enthalpien G statt dem
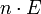 -Wert aufgetragen sind. Die Potentialdaten können sich auf Standardbedingungen (
-Wert aufgetragen sind. Die Potentialdaten können sich auf Standardbedingungen (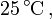
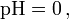
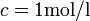 ) beziehen oder auf beliebige andere angegebene Bedingungen (z. B.:
) beziehen oder auf beliebige andere angegebene Bedingungen (z. B.: 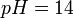 ).
).Erstellen
 Frost-Diagramm von Vanadium
Frost-Diagramm von VanadiumDiagramm für Vanadium in saurer Lösung (pH = 0):
1) Es werden die Standard-Potentiale von den relevanten Redox-Gleichgewichten aus einem Tabellenwerk entnommen:
2) Daraus werden die n·E-Werte ermittelt:
3) Die Werte werden in ein Koordinatensystem eingetragen.
Interpretation
Um zu entscheiden, ob eine Disproportionierung oder eine Synproportionierung stattfindet, muss geschaut werden, ob sich die mittlere Oxidationsstufe im Diagramm ober- oder unterhalb der Verbindungslinie der beiden äußeren Oxidationsstufen befindet. Z. B. synproportionieren hier
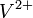 und
und 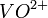 zu
zu 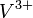 , da sich die mittlere Oxidationsstufe unterhalb der Verbindungslinie der beiden anderen befindet.
, da sich die mittlere Oxidationsstufe unterhalb der Verbindungslinie der beiden anderen befindet.Weblinks
Wikimedia Foundation.