- P-Nitroanilin
-
Nitroaniline Name o-Nitroanilin m-Nitroanilin p-Nitroanilin Andere Namen 2-Nitroanilin,
1-Amino-2-nitrobenzol
3-Nitroanilin,
1-Amino-3-nitrobenzol,
C.I. 370304-Nitroanilin,
1-Amino-4-nitrobenzol
Strukturformel 
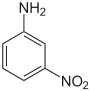

CAS-Nummer 88-74-4 99-09-2 100-01-6 PubChem 6946 7423 7475 Summenformel C6H6N2O2 Molare Masse 138,13 g·mol−1 Aggregatzustand fest Kurzbeschreibung gelbe bzw. orange, fast geruchlose, kristalline Pulver Schmelzpunkt 71 °C[1] 114 °C[2] 147 °C[3] Siedepunkt 284 °C[1] Zers.[2] 336 °C[3] pKs-Wert[4]
(der konjugierten Säure BH+)−0,26 2,466 1,00 Löslichkeit 1,3 g/l (20 °C)[1] 1,25 g/l (25 °C)[2] 0,568 g/l (25 °C)[3] schwerlöslich in Wasser, löslich in Ethanol, Ether und Chloroform Gefahrstoff-
kennzeichnung
[1][2][3]
Giftig (T) R-Sätze 23/24/25-33-52/53 S-Sätze (1/2)-28-36/37-45-61 Die Nitroaniline (selten: Aminonitrobenzole) sind aromatische Verbindungen mit der allgemeinen Summenformel C6H6N2O2. Sie leiten sich sowohl vom Anilin als auch vom Nitrobenzol ab. Durch unterschiedliche Anordnung der Substituenten ergeben sich drei Konstitutionsisomere.
Inhaltsverzeichnis
Darstellung
m-Nitroanilin kann gewonnen werden durch:
- Reduktion von m-Dinitrobenzol mit Natriumsulfid in wässriger Lösung
o-Nitroanilin kann zusammen mit p-Nitroanilin gewonnen werden durch:[5]
- Nitrierung und Hydrolyse von Acetanilid (eine Schutzgruppe ist erforderlich, da sonst neben der Nitrierung auch Oxidationen eintreten)
-
 Synthese von o-Nitroanilin bzw. p-Nitroanilin:
Synthese von o-Nitroanilin bzw. p-Nitroanilin:
Die NH2-Gruppe des Anilins (1) wird mittels Essigsäureanhydrid geschützt, dabei entsteht Acetanilid (2). Dieses wird unter Einwirken von Schwefelsäure, Salpetersäure sowie Essigsäure zu o-Nitroacetanilid (3a) bzw. p-Nitroacetanilid (3b) nitriert. Schließlich erfolgt die säurekataylierte Abspaltung der Schutzgruppe, so dass man o-Nitroanilin (4a) bzw. p-Nitroanilin (4b) erhält.
- Erhitzen von o- bzw. p-Chlornitrobenzol mit alkoholischem Ammoniak
- Sulfonierung, Nitrierung und Hydrolyse von Oxanilid und Acetanilid[6]
Die weltweite Produktion beträgt etwa 20 bis 25 tausend Tonnen pro Jahr.
Eigenschaften
Die Nitroaniline bilden gelbe bzw. orange kristalline Pulver. Sie sind schwerlöslich in Wasser, löslich in Ethanol, Ether und Chloroform.
pKs-Werte
Die Nitroaniline besitzen gegenüber dem Anilin (4,603[4]) deutlich niedrigere pKs-Werte; die elektronenziehende Nitrogruppe (−M-Effekt) setzt die Basizität herab. Ein Proton kann daher deutlich schlechter aufgenommen werden.
Im relativen Vergleich untereinander besitzen o- und p-Nitroanilin gegenüber dem m-Nitroanilin einen niedrigeren pKs-Wert; damit sind deren Basizitäten kleiner. Bei der ortho- und para-Form kann eine negative Ladung der elektronenschiebenden Aminogruppe (−I-Effekt und +M-Effekt) durch die elektronenziehende Nitrogruppe (−M-Effekt) besser stabilisiert werden. Bei der meta-Form ist das nicht möglich, so dass die relative Elektronendichte am Amino-Stickstoff größer ist und somit ein Proton eher aufgenommen werden kann.
Schmelzpunkte
Die Schmelzpunkte zeigen deutliche Unterschiede. Das o-Nitroanilin besitzt den niedrigsten Schmelzpunkt, da es eine intramolekulare Wasserstoffbrücke ausbilden kann. Die beiden anderen Isomere bilden im Gegensatz dazu intermolekulare Wasserstoffbrücken aus. Das p-Nitroanilin besitzt aufgrund seiner Symmetrie den höchsten Schmelzpunkt.
Verwendung
Die Nitroaniline werden fast ausschließlich als Zwischenprodukte zur Herstellung anderer organischer Verbindungen eingesetzt. So entstehen z. B. durch Hydrierung der Nitrogruppe die Phenylendiamine.
p-Nitroanilin ist z. B. Ausgangspunkt zur Synthese des Azofarbstoffs Pararot:[7]
 Synthese von Pararot ausgehend von p-Nitroanilin (1). Dieses reagiert nach Einwirken von Schwefelsäure und Natriumnitrit zu einem Diazoniumsalz (2), welches mit 2-Naphthol zum Pararot (3) gekuppelt wird.
Synthese von Pararot ausgehend von p-Nitroanilin (1). Dieses reagiert nach Einwirken von Schwefelsäure und Natriumnitrit zu einem Diazoniumsalz (2), welches mit 2-Naphthol zum Pararot (3) gekuppelt wird.Derivate
Einige Derivate des m-Nitroanilins schmecken sehr süß. Das 1-Propoxy-2-amino-4-nitrobenzol hat eine Süßkraft von 4.100 in Bezug auf Saccharose und wurde einige Zeit unter dem Namen Ultrasüß P-4000 als Süßstoff verwendet, hat aber aus toxikologischen Gründen keine Bedeutung mehr.[8]
Sicherheitshinweise
Nitroaniline sind giftig. Bei Kontakt von Nitroanilinen mit organischen Stoffen und Einwirkung von Feuchtigkeit kann eine spontane Entzündung erfolgen.
Weblinks
Siehe auch
- Dinitroaniline C6H5N3O4
- Trinitroaniline C6H4N4O6
- Tetranitroaniline C6H3N5O8
- Pentanitroanilin C6H2N6O10, CAS: 21985-87-5
Einzelnachweise
- ↑ a b c d Eintrag zu CAS-Nr. 88-74-4 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 6. März 2008 (JavaScript erforderlich).
- ↑ a b c d Eintrag zu CAS-Nr. 99-09-2 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 6. März 2008 (JavaScript erforderlich).
- ↑ a b c d Eintrag zu CAS-Nr. 100-01-6 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 6. März 2008 (JavaScript erforderlich).
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Beyer/Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 533, 535–536.
- ↑ Herstellung von o-Nitroanilin (englisch)
- ↑ J. R. Mohrig, T. C. Morrill, C. N. Hammond, D. C. Neckers: Synthesis 5: Synthesis of the Dye Para Red from Aniline, in: Experimental Organic Chemistry Freeman: New York, NY, 1997; S. 456–467.
- ↑ H.-D. Belitz et al.: Lehrbuch der Lebensmittelchemie, 5. Aufl., Springer, Berlin u. a., 2001. S. 432.
Wikimedia Foundation.

