- 1,4-Epoxybutan
-
Strukturformel 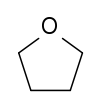
Allgemeines Name Tetrahydrofuran Andere Namen - Tetramethylenoxid
- 1,4-Epoxybutan
- Oxacyclopentan
- Oxolan
- THF
Summenformel C4H8O CAS-Nummer 109-99-9 Kurzbeschreibung farblose, etherartig riechende Flüssigkeit Eigenschaften Molare Masse 72,106 g·mol−1 Aggregatzustand flüssig
Dichte 0,8892 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt 64 °C[2]
Dampfdruck Löslichkeit mischbar mit Wasser[2], Alkoholen, Ketonen, Estern, Ethern und Kohlenwasserstoffen[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Leicht-
entzündlichReizend (F) (Xi) R- und S-Sätze R: 11-19-36/37 S: (2)-16-29-33 MAK 150 mg·m−3[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Tetrahydrofuran (THF) ist ein organisches Lösungsmittel und gehört zur Stoffklasse der (cyclischen) Ether.
Inhaltsverzeichnis
Physikalische Eigenschaften
Tetrahydrofuran ist eine farblose, brennbare Flüssigkeit mit etherartigem Geruch. Es ist mit Wasser und Alkoholen unbegrenzt mischbar. Bei einem Wassergehalt von 4,3 % wird ein azeotroper Siedepunkt von 63,5°C beobachtet.
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 4,12118, B = 1202,942 und C = −46,818 im Temperaturbereich von 296 K bis 373 K.[4]
Die wichtigsten thermodynamischen Eigenschaften sind in der folgenden Tabelle aufgelistet:
Eigenschaft Typ Wert [Einheit] Standardbildungsenthalpie ΔfH0gas −184.2 kJ·mol−1.[5] Standardentropie S0liquid
S0g203,9 J·mol−1·K−1[6]
als Flüssigkeit
301,7 J·mol−1·K−1[7]
als GasVerbrennungsenthalpie ΔcH0liquid −2505,8 kJ·mol−1[8] Wärmekapazität cp 124,1 J·mol−1·K−1 (25°C)[9]
als FlüssigkeitSchmelzenthalpie ΔfH0 8,540 kJ·mol−1 [6]
beim SchmelzpunktSchmelzentropie ΔfS0 51,8 kJ·mol−1 [6]
beim SchmelzpunktVerdampfungsenthalpie ΔVH0 29,8 kJ·mol−1.[10]
beim NormaldrucksiedepunktKritische Temperatur TC 268 °C[11] Kritischer Druck PC 51,9 bar[11] Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=Aexp(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 46,11 kJ/mol, β = 0,2699 und Tc = 540,2 K im Temperaturbereich zwischen 302 K und 339 K beschreiben. [10]
Sicherheitstechnische Kenngrößen
Tetrahydrofuran bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −20 °C. Der Explosionsbereich liegt zwischen 1,5 Vol% (46 g/m3) als untere Explosionsgrenze (UEG) und 12,4 Vol% (370 g/m3) als obere Explosionsgrenze (OEG).[2] Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von −24 °C sowie einen oberen Explosionspunkt von 13 °C. Die Grenzspaltweite wurde mit 0,87 mm bestimmt.[2] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[2] Die Zündtemperatur beträgt 230 °C. [12] Der Stoff fällt somit in die Temperaturklasse T3. Die elektrische Leitfähigkeit ist mit 4,6·10-8 S·m-1 eher gering.[13]
Entsprechend den Gefahrgutvorschriften ist Tetrahydrofuran der Klasse 3 (Entzündbare flüssige Stoffe) mit der Verpackungsgruppe II (mittlere Gefährlichkeit) zugeordnet (Gefahrzettel: 3).[2]
Chemische Eigenschaften
Wie viele Ether bildet auch THF beim längeren Stehen an der Luft und unter Lichteinwirkung durch Autoxidation ein Peroxid. Dieses kann beim Abdestillieren von THF als hochexplosiver Rückstand zurückbleiben. Es empfiehlt sich daher vor jeder Destillation von THF einen Peroxidtest durchzuführen und ggf. die Peroxide durch Behandeln mit festem Kaliumhydroxid auszufällen.
Beim Erhitzen in Anwesenheit von Salzsäure wird der Ether leicht unter Bildung von 4-Chlor-butanol und später 1,4-Dichlorbutan gespalten.[14]
Darstellung und Gewinnung
THF wird durch Hydrierung von Furan gewonnen. Die großtechnische Herstellung erfolgt durch die säurekatalysierte Cyclisierung von 1,4-Butandiol. Bei dieser Reaktion findet eine intramolekulare nukleophile Substitution statt, bei der Wasser abgespalten wird.
Verwendung
Tetrahydrofuran wird als Lösungsmittel für PVC, Polystyrol, Polyurethane, Cellulosenitrat, Klebstoffe und Lacke verwendet; es ist ein Zwischenprodukt bei der Polyamid-, Polyester- und Polyurethan-Herstellung, und es dient zur Gewinnung von Tetrahydrothiophen und Pyrrolidin. Es ist ein wichtiges Vorprodukt für Polytetrahydrofuran. In zahlreichen organischen Reaktionen wird es aufgrund seiner Donorwirkung als Lösungsmittel eingesetzt.
Neben Diethylether ist Tetrahydrofuran eines der wichtigsten Lösungsmittel für Reaktionen mit basischen und neutralen Reaktanden, da es gute Lösungseigenschaften besitzt und weitgehend inert ist. Bei Reaktionen mit stark (lewis-)sauren Reaktanden muss man mit Etherspaltung rechnen. Bei schwächer (lewis-)sauren Reaktanden geht Tetrahydrofuran oft Säure-Base-Addukte ein.
Ein verwandter cyclischer Ether ist 1,4-Dioxan.
Quellen
- ↑ a b The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1585, ISBN 978-0-911910-00-1.
- ↑ a b c d e f g h i Eintrag zu Tetrahydrofuran in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 3. Januar 2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 109-99-9 im European chemical Substances Information System ESIS
- ↑ Scott D.W.: Tetrahydrofuran: vibrational assignment, chemical thermodynamic properties, and vapor pressure in J. Chem. Thermodyn. 2 (1970) 833-837. Abstract
- ↑ Pell, A.S.; Pilcher, G.: Measurements of heats of combustion by flame calorimetry. Part 3.-Ethylene oxide, trimethylene oxide, tetrahydrofuran and tetrahydropy in Trans. Faraday Soc. 61 (1965) 71-77.
- ↑ a b c Lebedev, B.V.; Rabinovich, I.B.; Milov, V.I.; Lityagov, V.Ya.: Thermodynamic properties of tetrahydrofuran from 8 to 322 K in J. Chem. Thermodyn. 10 (1978) 321-329.
- ↑ Clegg G.A., Thermodynamics of polymerization of heterocyclic compounds. II. The heat capacity, entropy, enthalpy and free energy of polytetrahydrofuran in Polymer 9 (1968) 501-511
- ↑ Cass, R.C.; Fletcher, S.E.; Mortimer, C.T.; Springall, H.D.; White, T.R., Heats of combustion and molecular structure. Part V. The mean bond energy term for the C-O bond in ethers, and the structures of some cyclic ethers in J. Chem. Soc. 1958, 1406-1410.
- ↑ Costas, M.; Patterson, D.: Heat capacities of water + organic-solvent mixtures in J. Chem. Soc., Faraday Trans. 81 (1985) 2381-2398.
- ↑ a b Majer, V.; Svoboda, V., Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation, Blackwell Scientific Publications, Oxford, 1985, 300.
- ↑ a b Kobe, K.A.; Ravicz, A.E.; Vohra, S.P.: Critical Properties and Vapor Pressures of Some Ethers and Heterocyclic Compounds in J. Chem. Eng. Data 1 (1956) 50.
- ↑ E. Brandes, W. Möller: Sicherheitstechnische Kenndaten - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ Berufsgenossenschaftliche Regeln für Sicherheit und Gesundheit bei der Arbeit: BG-Regel 132 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand Juli 2004, Jedermann-Verlag Heidelberg.
- ↑ Autorenkollektiv: Organikum. 22. Auflage. Wiley-VCH, 2004, ISBN 978-3527311484.
Wikimedia Foundation.
