- Phenylmethan
-
Strukturformel 
Allgemeines Name Toluol Andere Namen - Retinnaphtha
- Methylbenzol
- Methylbenzen
- Anisen
- Toluen
- Phenylmethan
Summenformel C7H8 CAS-Nummer 108-88-3 Kurzbeschreibung farblose Flüssigkeit mit charakteristischem Geruch [1] Eigenschaften Molare Masse 92,14 g·mol−1 Aggregatzustand flüssig
Dichte 0,87 g·cm−3[1]
Schmelzpunkt −95 °C [1]
Siedepunkt 111 °C [1]
Dampfdruck 29 hPa (20 °C) [1]
Löslichkeit schwer löslich in Wasser: 470 mg·l−1 (20 °C) [1]
Brechungsindex 1,496 (20 °C, Na-D-Linie) Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Leicht-
entzündlichGesundheits-
schädlich(F) (Xn) R- und S-Sätze R: 11-38-48/20-63-65-67 S: (2)-36/37-62 MAK 50 ml·m−3, 190 mg·m−3 [1]
LD50 636mg/kg (Ratte, oral) [3]
WGK 2 – wassergefährdend [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Toluol, Trivialname nach IUPAC auch Toluen, Methylbenzol, Phenylmethan, nach IUPAC-Nomenklatur Methylbenzen genannt, ist eine farblose, charakteristisch riechende, flüchtige Flüssigkeit, die in vielen ihrer Eigenschaften dem Benzol ähnelt. Toluol ist ein aromatischer Kohlenwasserstoff, häufig ersetzt es als Lösungsmittel das giftige Benzol. Es ist unter anderem auch im Benzin enthalten.
Inhaltsverzeichnis
Geschichte
1844 wurde Toluol zum ersten Mal von Henri Etienne Sainte-Claire Deville durch trockene Destillation aus Tolubalsam gewonnen; hierauf beruht auch sein Name. Aus Toluol wurde 1861 durch den Chemiker Joseph Wilbrand zum ersten Mal – zwar nur unreines – TNT hergestellt, 1880 konnte es dann auch in reiner Form aus Toluol hergestellt werden. Die Großproduktion wurde in Deutschland schließlich im Jahre 1891 über die Nitrierung von Toluol aufgenommen, dieses Verfahren wird noch heute verwendet.
Vorkommen und Emissionen
Toluol kommt im Erdöl und in dem Leichtöl, das bei der Steinkohleteerdestillation anfällt, in kleineren Mengen vor. Toluol wird unter anderem durch Kfz-Verkehr freigesetzt, weil es im Benzin enthalten ist, und entsteht in kleinen Mengen bei der unvollständigen Verbrennung von organischen Stoffen, wie zum Beispiel beim Rauchen. In den letzten Jahren ist ein Rückgang der Toluolemissionen zu verzeichnen, das Jahresmittel beträgt zum Beispiel in Rheinland-Pfalz 30 µg/m3, je nach Ort kann es jedoch zu größeren Schwankungen dieses Wertes kommen. Hauptemissionsfaktor ist mit ca. 65 Prozent der Kfz-Verkehr, 33 Prozent sind auf den Gebrauch von Toluolprodukten und 2 Prozent auf die Toluolherstellung zurückzuführen. Freigesetztes Toluol wird in der Erdatmosphäre, wie beim Benzol, nach mehreren Tagen durch Reaktionen mit Hydroxylradikalen (OH-Radikale) abgebaut.
Gewinnung und Darstellung
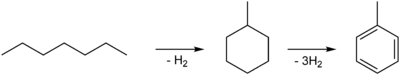
In der Industrie wird es hauptsächlich aus Erdöl gewonnen. Während des Zweiten Weltkrieges kam es in Deutschland wegen des fehlenden Erdöls zu Engpässen bei der Toluolherstellung, weswegen es auch aus Benzol und Methanol hergestellt wurde. Außerdem fällt es bei der Herstellung von Ethen und Propen an. Die Weltproduktion liegt jährlich zwischen fünf Millionen und zehn Millionen Tonnen. Eine direkte Herstellung aus Erdöl oder durch Trockendestillation von Steinkohle ist bei den aktuellen (2006) Rohölpreisen allerdings noch nicht wirtschaftlich. Deshalb wird es bei der Verarbeitung von Erdöl durch Cracken oder Dehydrocyclisierung von n-Heptan gewonnen:
Das Heptan wird zu Methylcyclohexan reformiert und danach zu Toluol dehydriert:
Photochemisch ist es durch Isomerisierung von Cycloheptatrien zugänglich.
Eigenschaften
Toluol ist der einfachste Vertreter der Alkylbenzole. An der Luft verbrennt es nur unvollständig mit gelber, stark rußender Flamme. Die Flüssigkeit riecht charakteristisch, stechend angenehm (ähnlich wie Benzol) und hat eine Geruchsschwelle von 0,6–263 mg/m3. Toluol schmilzt bei −95 °C, siedet bei 111 °C und ist bei Normalbedingungen eine farblose, klare, wasserhelle Flüssigkeit, die stark lichtbrechend ist (Brechungsindex: 1,4961). In Wasser ist es fast unlöslich (0,47 g/l); mit Kohlenstoffdisulfid, Alkohol und Ether ist es in jedem Verhältnis mischbar. Auch in Chloroform, Aceton und den meisten weiteren organischen Lösungsmitteln ist Toluol gut löslich. Die dynamische Viskosität beträgt 0,6 mPa s, Toluol ist also dünnflüssiger als Wasser. Der Heizwert beträgt 40.940 kJ/kg, sein Flammpunkt liegt bei 6 °C und die Zündtemperatur bei 535 °C.
Chemische Eigenschaften
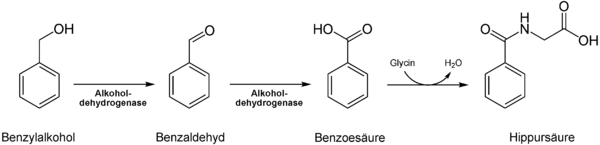
Toluol ist bei Normalbedingungen stabil und relativ reaktionsträge, mit Oxidationsmitteln und Säuren reagiert es jedoch heftig. Es geht ähnliche Reaktionen ein wie Phenol und Benzol; die Reaktivität von Toluol liegt zwischen diesen beiden Verbindungen. Toluol greift viele Kunststoffe an und wird deswegen meist in Glas- oder Metallbehältern aufbewahrt. Durch Oxidation (zum Beispiel mit saurer Kaliumpermanganat-Lösung) kann Toluol über Benzylalkohol und Benzaldehyd zu Benzoesäure umgewandelt werden. Toluol geht vor allem radikalische Substitutionsreaktionen, elektrophile Substitutionsreaktionen und radikalische Additionsreaktionen ein. Nukleophile Substitutionsreaktionen sind seltener.
Insbesondere in der Hitze oder unter Bestrahlung mit Licht kann Toluol mit geeigneten Reaktionspartnern (beispielsweise Brom) radikalische Substitutionsreaktionen an der Methylgruppe eingehen (siehe SSS-Regel):
Da Toluol relativ reaktionsträge ist, laufen elektrophile Substitutionsreaktionen an ihm nur relativ langsam ab. In Gegenwart eines geeigneten Katalysators kann die Reaktionsgeschwindigkeit erheblich gesteigert werden (siehe KKK-Regel). Es entstehen bevorzugt para- und orthosubstituierte Produkte:
.png) Reaktion von Toluol mit Brom in Gegenwart einer Lewis-Säure (FeBr3)
Reaktion von Toluol mit Brom in Gegenwart einer Lewis-Säure (FeBr3)Toluol reagiert mit Salpetersäure zu 4-Nitrotoluol und Wasser, daneben entsteht auch das isomere 2-Nitrotoluol. Das eigentliche nitrierende Agens (NO2+) wird in Gegenwart von Schwefelsäure aus Salpetersäure gebildet:
.png) Nitrierung von Toluol
Nitrierung von ToluolEine weitere, wichtige Reaktion ist die Oxidation von Toluol zu Benzoesäure.
Sicherheitshinweise
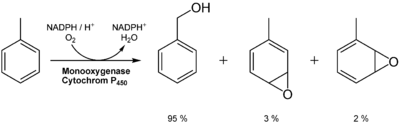
Toluol ist gesundheitsschädlich (Xn) und leichtentzündlich (F). Toluol selbst wirkt nicht erbgutverändernd, ist jedoch häufig mit Benzol verunreinigt. Die geringere Giftigkeit von Toluol gegenüber Benzol lässt sich mit seinem anderen Metabolismus erklären. Toluol wird im Gegensatz zum Benzol kaum durch Oxidation des Ringes, sondern hauptsächlich durch Oxidation der Seitenkette zur Benzoesäure metabolisiert. Der Grund dafür ist die hohe Selektivität des Monoxygenasesystems P450 für die Methylgruppe des Toluols. Aus diesem Grund entsteht kaum karzinogenes Epoxid wie im Falle des Benzols. Die geringen Mengen an Epoxid können durch Konjugation an Glutathion, spontane intramolekulare Umlagerung zum Phenol oder durch enzymatische Hydrolyse zum Diol abgebaut werden.
In Form von Benzoesäure und Hippursäure wird Toluol, neben kleinen Mengen o-Kresol, über den Harn ausgeschieden.
Toluol verursacht Nerven-, Nieren- und möglicherweise auch Leberschäden. Toluol ist fortpflanzungsgefährdend sowie fruchtschädigend. Die Inhalation von Toluoldämpfen kann zu unspezifischen Symptomen wie Müdigkeit, Unwohlsein, Empfindungsstörungen, Störungen der Bewegungskoordination und Bewusstseinverlust führen. Bei regelmäßigem Kontakt kann es zu einer Toluolsucht kommen, die mit Heiterkeits- und Erregungsräuschen einhergeht. Toluoldämpfe haben eine narkotisierende Wirkung und reizen die Augen und Atmungsorgane schwer, allergische Reaktionen auf Toluol sind möglich. Toluol sollte an gut belüfteten Orten aufbewahrt werden.
Toluol ist selbst in geringen Mengen, obwohl es nicht wasserlöslich ist, wassergefährdend (WGK 2). Es ist biologisch leicht abbaubar. Zwischen einem Luftvolumenanteil von 1,1 bis 7,8 Prozent bildet es explosive Gemische.
Quellen
- ↑ a b c d e f g h Eintrag zu Toluol in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 7. Feb. 2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 108-88-3 im European chemical Substances Information System ESIS
- ↑ Toluene bei ChemIDplus
Literatur
- Unterausschuss Wirkungsfragen des LAI: Bewertung von Toluol- und Xylol-Immissionen. Erich Schmidt Verlag, Berlin 1997, ISBN 3-50304071-4
- Jürgen Angerer: Prävention beruflich bedingter Gesundheitsschäden durch Benzol, Toluol, Xylole und Ethylbenzol. Gentner, Stuttgart 1983, ISBN 3-87247311-5
- A. Seeber, M. Blaszkewicz, P. Demes: Toluol in Tiefdruckereien. Abschlussbericht zu einem Forschungsprojekt. HVBG, Sankt Augustin 2002, ISBN 3-88383623-0
- H. Greim: Gesundheitsschädliche Arbeitstoffe. Toxikologisch-arbeitsmedizinische Begründung von MAK-Werten. Toluol. VCH, Weinheim 1985, ISSN 0930-1984
Weblinks
Wikimedia Foundation.

.png)