- Phenylmethanal
-
Strukturformel 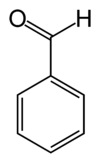
Allgemeines Name Benzaldehyd Andere Namen - Benzencarbaldehyd (IUPAC)
- Benzolcarbaldehyd
- Falsches Bittermandelöl
- Phenylmethanal
Summenformel C7H6O CAS-Nummer 100-52-7 PubChem 240 Kurzbeschreibung farblose Flüssigkeit Eigenschaften Molare Masse 106,1 g·mol−1 Aggregatzustand flüssig
Dichte 1,05 g·cm−3 (20 °C) [1]
Schmelzpunkt −26 °C [1]
Siedepunkt 179 °C [1]
Dampfdruck 1,3 hPa [1] (20 °C)
Löslichkeit 3,3 g·l−1 (20 °C) in Wasser [1]
Brechungsindex 1,5446 (20 °C)[2] Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: (2)-24 LD50 1300 mg/kg [1]
WGK 2 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Benzaldehyd (auch falsches Bittermandelöl genannt), ist eine farblose Flüssigkeit, die bei 179 °C siedet. Er ist eine wichtige Grundchemikalie mit einem Flammpunkt von 64 °C und eine Zündtemperatur von 190 °C.[1]
Benzaldehyd ist gesundheitsschädlich, wobei eine echte Gesundheitsgefährdung für gewöhnlich nur bei vergleichsweise großen aufgenommenen Mengen zu erwarten ist. Er riecht angenehm süßlich nach echtem Bittermandelöl (das zu über 90% aus Benzaldehyd besteht) bzw. nach dem aus Mandeln und Zucker gefertigten Marzipan. Der Geschmack des Benzaldehyds wird allgemein als charakteristisch marzipanartig, jedoch im Reinzustand auch als unangenehm brennend empfunden. In großer Verdünnung, hierbei vor allem mit Ethanol, tritt in zunehmendem Maße eine Wildkirschnote zum Aroma hinzu.
Inhaltsverzeichnis
Struktur
Benzaldehyd ist der einfachste aromatische Aldehyd. Er leitet sich vom Benzol ab und ist chemisch und strukturell eng mit der Benzoesäure verwandt, die aus ihm durch Oxidation gewonnen werden kann.
Herstellung
- Durch radikalische Chlorierung von Toluol erhält man α,α-Dichlortoluol (Benzylidendichlorid), das mit Wasser zu Benzaldehyd (und HCl) umgesetzt werden kann. Entsprechend erhält man Benzaldehyd auch durch radikalische Bromierung von Toluol und anschließende Hydrolyse. In beiden Fällen tritt beim letzten Reaktionsschritt eine nukleophile Substitution von Halogenid auf.
- Auch eine 'direkte' Oxidation von Toluol zu Benzaldehyd ist möglich. Da Benzaldehyd aber leicht zu Benzoesäure oxidiert wird, müssen dabei aber entweder selektive Oxidationsmittel verwendet werden oder es muss das entstehende Benzaldehyd mit einer schnellen Reaktion 'abgefangen' und so vor weiterer Oxidation geschützt werden.
Reaktionen
- Benzaldehyd C6H5–CHO wird leicht zu Benzoesäure C6H5–COOH oxidiert. Diese Reaktion erfolgt – wenn auch sehr langsam – auch bei Raumtemperatur und mit Luftsauerstoff (Autoxidation), so dass Benzaldehyd oft mit Benzoesäure verunreinigt ist (bei größeren Mengen als weißer Feststoff im flüssigen Aldehyd). Als Zwischenstufe wird hierbei Peroxybenzoesäure gebildet.
- Benzaldehyd geht für Aldehyde typische Reaktionen ein, die auch zum Nachweis und zur Identifizierung geeignet sind. Es reagiert beispielsweise mit Hydrazin H2N–NH2 und seinen Derivaten (beispielsweise mit Phenylhydrazin C6H5–NH–NH2 unter Bildung eines Phenylhydrazons).
- Die für die Aromaten typische elektrophile Substitution ist beim Benzaldehyd ebenfalls möglich. Bei der Nitrierung müssen die Reaktionsbedingungen sorgfältig gewählt werden, da die Oxidation zu Benzoesäure als Nebenreaktion auftritt. Aus diesem Grund liegt die Ausbeute an Nitrobenzaldehyd meist unter 50 %.
- Benzoin-Addition: Zwei Moleküle Benzaldehyd können sich in Gegenwart von Cyanid als Katalysator zu Benzoin vereinigen. Allgemein versteht man unter der Benzoin-Addition die entsprechende Reaktion aromatischer Aldehyde (mit Benzaldehyd als einfachstem Vertreter).
Einzelnachweise
- ↑ a b c d e f g h Sicherheitsdatenblatt (Merck).
- ↑ Autorengemeinschaft: Organikum, 22. Auflage, Wiley-VCH, 2004, ISBN 3-527-31148-3, S. 236.
- ↑ Eintrag zu CAS-Nr. 100-52-7 im European chemical Substances Information System ESIS
Wikimedia Foundation.
