- Phosphatgruppe
-
Phosphate 
Das Anion PO43−
Ein Kondensat: Diphosphat
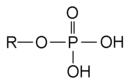
Ein Ester: PhosphorsäureesterPhosphate sind die Salze und Ester der ortho-Phosphorsäure. Das Anion PO43−, sowie seine Kondensate (Polymere) und Phosphorsäureester werden Phosphate genannt. Phosphor liegt bei allen diesen Verbindungen in der Oxidationsstufe (V) vor. Sauerstoffverbindungen des Phosphors mit anderen Oxidationsstufen sind unter Phosphor aufgelistet.
Inhaltsverzeichnis
Varianten
Primäre, sekundäre und tertiäre Phosphate
Die Salze der dreibasigen ortho-Phosphorsäure (H3PO4) lassen sich in primäre, sekundäre und tertiäre Phosphate einteilen. Bei einwertigen Kationen M′ gelten die Summenformeln entsprechend M′1H2PO4, M′2H1PO4 und M′3PO4. Durch die teilweise Neutralisation der Phosphorsäure erhält man Hydrogen- oder Dihydrogenphosphate. Diese können sowohl mit Säuren als auch mit Basen reagieren. Wegen dieser Eigenschaft enthalten viele Pufferlösungen Hydrogenphosphate.
primäre Phosphate
(Dihydrogenphosphate)sekundäre Phosphate
(Hydrogenphosphate)tertiäre Phosphate Natriumdihydrogenphosphat, NaH2PO4 Dinatriumhydrogenphosphat, Na2HPO4 Natriumphosphat, Na3PO4 Kaliumdihydrogenphosphat, KH2PO4 Dikaliumhydrogenphosphat, K2HPO4 Kaliumphosphat, K3PO4 Calciumdihydrogenphosphat, Ca(H2PO4)2 Calciumhydrogenphosphat, CaHPO4 Calciumphosphat, Ca3(PO4)2 Weitere Beispiele siehe Kategorie:Phosphat Kondensate
Phosphorsäure kann in einer Kondensationsreaktion (Wasserabspaltung) Diphosphorsäure (H4P2O7) bilden. Analog gibt es entsprechende Salze, die Diphosphate (Pyrophosphate) M'4P2O7. Bei einer fortgesetzten Reaktion bilden sich auch poly- oder cyclo-Phosphate. cyclo-Phosphate werden oft Metaphosphate genannt. Polyphosphate und Metaphosphate sind also Polymere der Salze der Phosphorsäure.
di-, poly- und cyclo-Phosphate Name Reaktion Struktur des Anions di-Phosphat
(auch: Pyrophosphat)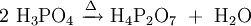

tri-Phosphat
(allg.: poly-Phosphat)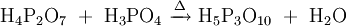

meta-Phosphat
(allg.: cyclo-Phosphat)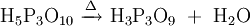

Pentanatriumtriphosphat (Na5P3O10) und Metaphosphate wurden zur Wasserenthärtung in Waschmitteln verwendet. Als Lebensmittelzusatzstoffe finden z.B. Pentanatriumtriphosphat und Diphosphate Anwendung.
Phosphorsäureester
Phosphorsäureester sind Ester der ortho-Phosphorsäure.
Beispiele:
Gewinnung
Phosphate werden aus Mineralen wie zum Beispiel Apatit, Ca5[(PO4)3(OH,F,Cl)], gewonnen. Die Hauptvorkommen liegen im nördlichen Afrika (Marokko, Westsahara), Florida, Russland (Kola-Halbinsel), Südafrika und China. Früher fanden sich die Phosphatvorkommen mit der höchsten Konzentration (Nauruit, welches aus Guano entstand) auf der Pazifikinsel Nauru. Die ursprünglichen Vorkommen sind seit 2003 erschöpft. 2004 wurden neue Vorkommen auf Nauru erschlossen. Saudi-Arabien beabsichtigt (2005), in den nächsten Jahren die Ausbeutung seines Phosphatvorkommens voranzutreiben.
Die Ressourcen von Phosphaten sind begrenzt, und die meisten sind belastet mit Cadmium und/oder radioaktiven Schwermetallen. Manche Phosphatlagerstätten dienten bislang als Quelle für Uran. Man geht davon aus, dass die zur Düngerproduktion nutzbaren Phosphatlagerstätten früher erschöpft sein werden als die weltweiten Erdölvorkommen. Der Cadmiumgehalt der Phosphatlagerstätten ist sehr unterschiedlich. Viele Industrieländer haben bereits einen Grenzwert für Cadmium in Düngemitteln eingeführt.[1] So ist weltweit nur noch eine Lagerstätte bekannt, die den Grenzwert der EU unterschreitet (Kola). In Entwicklungsländern dagegen wird Düngung mit billigeren cadmiumverunreinigten Phosphatdüngern durchgeführt.
Die früher in den Industrieländern praktizierte Nutzung von Thomasmehl (einem Nebenprodukt der Eisenerz-Verhüttung) ist auf Grund der hohen Chrombelastung aus Gesundheitsgründen ausgeschlossen.
Es wäre daher sinnvoll die im Klärschlamm vorhandenen gefällten oder biologisch angereicherten Phosphate zu nutzen oder zurückzugewinnen. In Deutschland und anderen Ländern geht man allerdings immer mehr dazu über Klärschlamm zu verbrennen, da er neben den interessanten Phosphaten auch zahlreiche Schwermetalle und endokrine Disruptoren enthält.
Eigenschaften
Anionen und pH-Werte
In wässriger Lösung existieren Phosphat-Anionen in vier Formen. Unter stark basischen Bedingungen liegt das Phosphat-Anion hauptsächlich als (PO43−) vor, während unter schwach basischen Bedingungen das Hydrogenphosphat-Anion (HPO42−) dominiert. Unter schwach sauren Bedingungen liegt hauptsächlich das Dihydrogenphosphat-Anion (H2PO4−) vor. In stark saurer wässriger Lösung, ist Phosphorsäure (H3PO4) die Hauptform.
Es liegen also drei pH-abhängige Gleichgewichtsreaktionen vor:
Gleichgewichtsreaktionen Gleichgewichtskonstante bei 25 °C 
(1) 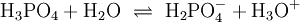
![K_{a1}=\mathrm{\frac{[H_2PO_4^-][H_3O^+]}{[H_3PO_4]}} \simeq 7{,}5\times10^{-3}](/pictures/dewiki/97/a223b728a16feecd5610651e1d512a6f.png)
(2) 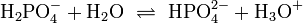
![K_{a2}=\mathrm{\frac{[HPO_4^{2-}][H_3O^+]}{[H_2PO_4^-]}} \simeq 6{,}2\times10^{-8}](/pictures/dewiki/101/edaacb803b567195c40ad9af7f64228a.png)
(3) 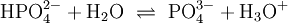
![K_{a3}=\mathrm{\frac{[PO_4^{3-}][H_3O^+]}{[HPO_4^{2-}]}} \simeq 2{,}14\times10^{-13}](/pictures/dewiki/51/3215f2b4a7233258b0a63879c4bb7f3a.png)
Unter stark alkalischen Bedingungen, wie z. B. bei pH = 13 liegt im wesentlichen PO43− und HPO42− vor. Ist die Lösung neutral (pH = 7.0) liegen H2PO4− (62 %) und HPO42− (38 %) vor. Bei pH = 7.4 dreht sich das Verhältnis der beiden Komponenten etwa um: 39 % H2PO4− und 61 % HPO42−. Unter stark sauren Bedingungen (pH=1) ist H3PO4 dominierend im Vergleich zu H2PO4−. HPO42− und PO43− sind praktisch abwesend.
Allgemeines
Mit Ausnahme der Alkali- und Ammonium-Verbindungen sind die meisten Phosphate schlecht wasserlöslich.
Phosphate können Verbindungen mit Schwermetallen eingehen. Diese Eigenschaft macht die Verwendung von Phosphaten problematisch, da die Phosphate aus dem Klärschlamm Schwermetalle mobilisieren können.
Zum überwiegenden Teil enthalten Lagerstätten von Phosphatverbindungen auch Schwermetalle, wie z.B. Cadmium und Uran.
Bedeutung in der Biochemie
Phosphate bzw. Phosphatreste spielen eine wichtige Rolle in der Biochemie lebender Organismen. Sie sind beteiligt am Aufbau biologisch wichtiger Moleküle, etwa der Desoxyribonukleinsäure (DNA). Im Phosphodiester/Phosphotriester-System von Adenosindiphosphat (ADP) und Adenosintriphosphat (ATP) wird ADP durch Übertragung einer Phosphatgruppe "energetisch aufgeladen" (ADP + Pi + Energie => ATP) und ATP kann durch Abspaltung einer Phosphatgruppe - an anderer Stelle in der Zelle - wieder Energie abgeben (ATP => ADP + Pi + Energie). Wichtig in der Biochemie ist auch die Phosphorylierung, d.h. die selektive Übertragung von Phosphat auf Proteine. Kovalent an Proteine gebundenes Phosphat wirkt als molekularer Schalter und ermöglicht Regulation von metabolischen Vorgängen. Übertragen werden sie hier von der großen Klasse der Proteinkinasen, wieder abgespalten von Proteinphosphatasen.
Bedeutung für die Ernährung
In der menschlichen Ernährung kommt Phosphat eine wesentliche Rolle im Energiestoffwechsel (siehe Abschnitt Biochemie) und im Knochenaufbau zu. Es verbindet sich mit Calcium zum festen Calciumapatit. Die im Zusammenhang mit Calcium oft angesprochene Bedeutung von Phosphat bezieht sich auf die indirekte Regulation des Knochenstoffwechsels. Phosphat steigert das Parathormon und erhöht somit die Freisetzung von Calcium aus den Knochen, drosselt die Calciumausscheidung der Niere und erhöht die Calciumresorption im Darm. Die Bedeutung von Phosphat für das Auftreten von Hyperaktivität bei Kindern gilt als widerlegt.
Verwendung
Dünger
Die Hauptmenge der Phosphate kommt als Dünger zum Einsatz (siehe Superphosphat, Doppelsuperphosphat). Durch Erosion von landwirtschaftlichen Flächen gelangen sie an Tonminerale gebunden in Flüsse und Seen. Dort können sie zur Eutrophierung beitragen und ihre Spurenstoffe wie Cadmium und Uran anreichern.
Waschmittelzusatz
Zur Enthärtung von Wasser kann Pentanatriumtriphosphat verwendet werden. Auf den Einsatz von Phosphaten in Waschmitteln wird in Teilen Europas inzwischen verzichtet, da sie zu einer Überdüngung und schließlich zum Umkippen von Gewässern geführt haben.
Lebensmittelzusatzstoff
Natriumphosphat (E 339), Kaliumphosphat (E 340), Calciumphosphat (E 341) und die Salze der ortho-Phosphorsäure Diphosphat (E 450), Triphosphat (E 451) und Polyphosphat (E 452) sind als Lebensmittelzusatzstoffe zugelassen und werden als Konservierungsmittel, Säuerungsmittel, als Säureregulator und Emulgator eingesetzt. Phosphat wird für nichtalkoholische, aromatisierte Getränke (Colagetränke; in diesen auch als Phosphorsäure (E338)), sterilisierte und ultrahocherhitze Milch, eingedickte Milch, Milch- und Magermilchpulver und als technischer Hilfsstoff (verhindert das Zusammenklumpen von rieselfähigen Lebensmitteln) verwendet. Phosphate spielen auch bei der Lebensmittelherstellung (vor allem in der Fleischindustrie) eine sehr große Rolle und sind Komponenten des Schmelzsalzes für Schmelzkäse.
Sonstige Verwendungen
Futtermittel, Korrosionsschutzmittel (siehe Phosphatierung); Flammschutzmittel; Puffersubstanz für neutralen pH-Bereich (s.o.).
Nachweis
Nachweisreaktionen von Phosphaten werden unter Phosphor beschrieben.
Einzelnachweise
- ↑ IGBCE. Stellungnahme der IG Bergbau, Chemie, Energie zum Entwurf für eine EU-weite Regelung des Europäischen Parlamentes und Rates für Cadmium in Düngemitteln
Weblinks
Wikimedia Foundation.