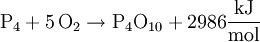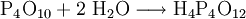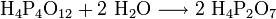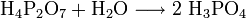- Phosphor(V)-oxid
-
Strukturformel 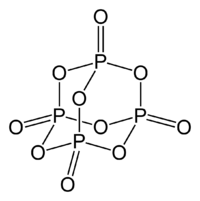
Allgemeines Name Phosphorpentoxid Andere Namen - Phosphor(V)-oxid
- Phosphorpentaoxid
- Diphosphorpentoxid
- Tetraphosphordecaoxid
Summenformel P2O5
P4O10CAS-Nummer 1314-56-3 PubChem 14812 Kurzbeschreibung farbloses, hygroskopisches Pulver Eigenschaften Molare Masse 141,96 g·mol−1 (P2O5) Aggregatzustand fest
Dichte 2,30 g·cm−3[1]
Schmelzpunkt 340–360 °C [1]
Löslichkeit mit Wasser Zersetzung zu Phosphorsäure
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Ätzend (C) R- und S-Sätze R: 35 S: (1/2)-22-26-45 MAK 2 mg·m−3
(Empfehlung, kein geltendes Recht) [1]Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Phosphorpentoxid, genauer Diphosphorpentoxid, ist ein Oxid des Elementes Phosphor. Es ist ein farb- und geruchloses, äußerst hygroskopisches Pulver, das mit Wasser in stark exothermer Reaktion zu Phosphorsäure umgesetzt wird.
Obwohl lange bekannt ist, dass das Molekül die Formel P4O10 hat, ist die historische Bezeichnung (Di)phosphorpentoxid erhalten geblieben.
Inhaltsverzeichnis
Herstellung
Phosphorpentoxid entsteht bei der Verbrennung von weißem Phosphor in einem trockenen Luftstrom unter starker Wärmeentwicklung:
Bei Sauerstoffmangel entsteht auch Phosphortrioxid P4O6, bei dem die vier „äußeren“ (in der obigen Formel doppelt an ein Phosphoratom gebundenen) Sauerstoffatome fehlen.[4]
Eigenschaften
Phosphorpentoxid hat ein großes Bestreben, Wasser aufzunehmen und Metaphosphorsäure zu bilden:
Das Gleichgewicht liegt hier fast vollständig auf der rechten Seite, so dass sich in einem Phosphorpentoxid enthaltenden, abgeschlossenen Raum ein Wasserdampfdruck von unter 1,3·10−4 Pa einstellt.
Weitere Wasseraufnahme führt über Polyphosphorsäuren
Verwendung
Phosphorpentoxid ist auf Grund des vorstehend dargestellten Gleichgewichts ein äußerst wirksames Trocknungsmittel (siehe Exsikkator): Wassermoleküle aus der umgebenden Luft, die auf Phosphorpentoxid treffen, werden sehr stark gebunden.
In Gasen, Flüssigkeiten und Feststoffen enthaltenes Wasser hat einen höheren Wasserdampfdruck, wodurch die Wassermoleküle nach und nach fast vollständig zum Phosphorpentoxid wandern. Davon betroffen sind auch chemisch gebundenes Wasser (siehe Hydrat) und sogar getrennt gebundene Wasserstoff- und Hydroxyl-Gruppen in organischen Molekülen oder biologischem Material: Auch diese haben einen gewissen „Wasserdampfdruck“, d.h., eine OH-Gruppe bildet mit einem benachbart gebundenen H gelegentlich ein Wassermolekül, was bei extremer Lufttrockenheit verdunstet. In der uns umgebenden, Wasserdampf enthaltenden Luft spielt dieses Gleichgewicht keine Rolle, aber ein Stück Würfelzucker wird im Exsikkator schwarz wie der im Backofen vergessene Kuchen (dem das Wasser auf dem gleichen Wege durch die Hitze verloren ging).
Düngemittel enthalten Phosphate wie z. B. Kaliumdihydrogenphosphat KH2PO4 oder Diammoniumhydrogenphosphat (NH4)2HPO4, wobei der Gehalt an Phosphor oft auf Phosphorpentoxid (P2O5) umgerechnet angegeben wird.
Sicherheitshinweise
Phosphorpentoxid ruft schwere Verätzungen hervor. Deswegen sind bei der Handhabung Handschuhe, Atemschutz und entsprechende Laborkleidung zu tragen.
Quellen
- ↑ a b c Eintrag zu Phosphorpentoxid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 27. März 2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 1314-56-3 im European chemical Substances Information System ESIS
- ↑ Holleman, Arnold F., Wiberg, Egon: "Lehrbuch der anorganischen Chemie", 91.-100. Aufl., Berlin, New York, 1985, S. 644
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 541-2.
Wikimedia Foundation.