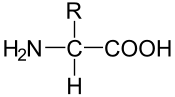
- Polypeptidkette
-
Ein Peptid ist eine organische chemische Verbindung, die aus einer Verknüpfung mehrerer Aminosäuren entstanden ist[1]. Dabei sind die einzelnen Aminosäuren in einer definierten Reihenfolge (Sequenz) zu einer, meist unverzweigten, Kette verbunden. Die Aminosäuren in Peptiden und in den größeren Proteinen sind über Amidbindungen miteinander verbunden. Wegen der großen Bedeutung der Peptide in der Biochemie und organischen Chemie wird diese Bindung heute nur noch Peptidbindung genannt.
Peptide unterscheiden sich von Proteinen allein durch ihre Größe, d. h. Anzahl der verknüpften Aminosäuren, also ihrer Molaren Massen. Die Definition von wann ab Peptide in Proteine übergehen ist unscharf; ab ungefähr 100 verknüpften Aminosäuren wird das Molekül als Protein bezeichnet.
In der Natur werden Peptide vorwiegend durch die Proteinbiosynthese aus α-Aminosäuren in der natürlichen L-Form gebildet. Peptide erfüllen eine große Anzahl an physiologischen Funktionen. Die Wirkungsweise ist heutzutage in den meisten Fällen gut erforscht. Peptide können als Hormon wirken, andere zeigen eine entzündungshemmende oder entzündungsfördernde Wirkung, darüber hinaus gibt es antibiotische und antivirale Wirkung.
Einige in der Nahrung häufig auftretende Proteine wie Gluten, Kasein oder auch in Ei oder Spinat vorhandene Eiweiße können durch die Verdauungsprozesse zu sogenannten opioiden Peptiden umgesetzt werden. Diese Peptide wirken in ähnlicher Weise wie Morphin auf den Körper. Personen, die nicht in der Lage sind diese Peptide weiter zu verstoffwechseln, können Anzeichen körperlicher und geistiger Krankheit entwickeln.
Der Begriff Peptid wurde erstmals 1902 von Emil Fischer auf der 74. Jahresversammlung Deutscher Naturforscher und Ärzte in Karlsbad geprägt[2]. Peptid ergibt sich aus Pepton (peptos, griech. verdaut), den Proteinabbauprodukten des Pepsines und der Endung von Polysaccharid, wegen der Analogie zu ihrem Aufbau aus Monomeren.
Inhaltsverzeichnis
Struktur
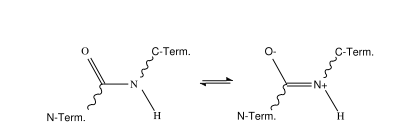 Mesomere Grenzstrukturen der Peptidbindung.
Mesomere Grenzstrukturen der Peptidbindung.Bei der Kondensation von Aminosäuren reagiert die Carboxyl-Gruppe der einen Aminosäure formal unter Wasseraustritt mit der Aminogruppe der anderen Aminosäure zur Säureamidgruppierung -CO-NH- (Peptidbindung). Die freie Aminogruppe an einem Ende des Peptids nennt man N-Terminus, die freie Carboxylgruppe am anderen Ende wird C-Terminus genannt.
Die Peptidbindung ist nicht frei drehbar, da es zwei Resonanzstrukturen gibt. Dies spielt eine wichtige Rolle bei der Struktur von Proteinen
Einteilung
Generell bezeichnet man die Anzahl der Aminosäuren, aus denen ein Peptidmolekül besteht, auch als Kettenlänge. Anhand der Kettenlänge differenziert man in
- Oligopeptide – bestehend aus bis zu 10 Aminosäuren
-
- Dipeptide – aus 2 Aminosäuren
- Tripeptide – aus 3 Aminosäuren
und
- Polypeptide – bestehend aus mehr als 10 Aminosäuren
-
- Makropeptide – aus mehr als 100 Aminosäuren,
wobei die eingerückten Peptidgruppen nur eine feinere Einteilung der Oligo- und Polypeptiden darstellt. Die Abgrenzung zwischen Oligo- und Polypeptiden einerseits und zwischen Polypeptiden und Proteinen andererseits ist dabei nicht scharf; die angegebenen Grenzen der Kettenlängen sind vielmehr grobe Richtwerte.
Oligopeptide
Als Oligopeptide werden chemische Verbindungen bezeichnet, die aus bis zu zehn Aminosäuren bestehen, die untereinander über Peptidbindungen verknüpft sind.
Gebildet wird ein Oligopeptid indem unter Wasserabspaltung die Aminogruppe einer ersten Aminosäure mit der Carboxylgruppe einer zweiten Aminosäure reagiert. Daraufhin reagiert die freie Aminogruppe des entstandenen Dipeptids mit der Carboxylgruppe einer weiteren Aminosäure. Nach diesem Muster werden die übrigen Aminosäuren angeknüpft, so dass eine kurze Kette von Aminosäuren entsteht, die über Peptidbindungen miteinander verbunden sind.
Oligopeptide spielen z. B. als Bestandteile von Enzymen bei Entgiftungs-, Transport- und Stoffwechselprozessen eine Rolle.
Polypeptide
Ein Polypeptid ist ein Peptid, das aus mindestens zehn Aminosäuren besteht. Die Aminosäuren sind durch Peptidbindungen verbunden. Polypeptide können sowohl natürlichen als auch synthetischen Ursprungs sein. Polypeptide mit über 100 Aminosäuren werden in der Regel als Proteine bezeichnet; allerdings sind für ein Protein weitere Voraussetzungen notwendig, so etwa eine definierte Proteinfaltung.
In der Natur werden Polypeptide durch die Mechanismen der Proteinbiosynthese aufgrund der Bauvorschrift, die in der DNA bzw RNA codiert ist, gebildet.
Sind hochmolekulare Makropeptide durch Wasserstoff- oder Disulfidbrücken verbunden, nennt man diese Proteine. Je nach geschichtlicher Einordnung werden auch einige Aminosäurenketten mit über 100 Aminosäuren als Peptide bezeichnet.
Peptidsynthese
Die Synthesemethode der Wahl für ein Peptid bestimmter Sequenz unterscheidet sich je nach dessen Länge:
- Kurze Peptide werden schrittweise aus der Verknüpfung von Aminosäuren aufgebaut
- Längere Peptide werden aus der Verknüpfung kürzerer Peptide aufgebaut
Wird versucht ein bestimmtes Dipeptid (z. B. Gly-Val) aus zwei verschiedenen Aminosäuren (Gly + Val) durch thermische Dehydratisierung herzustellen, entstehen eine Reihe von unerwünschten Produkten in beachtlicher Menge[3]:
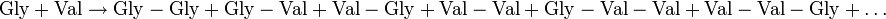
Um die Selektivität (Chemie) zu erhöhen, werden die Carboxyl- und Aminogruppen, die nicht verknüpft werden sollen, mit einer Schutzgruppe versehen (z. B. Ester, Boc):
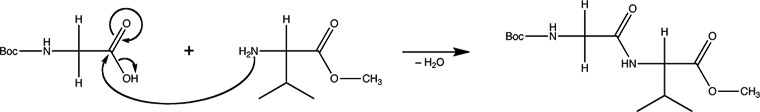
Weil sich die Schutzgruppen durch Säuren und Basen abspalten lassen, sind milde Reaktionsbedingungen nötig. Es werden verschiedene Kopplungsreagenzien verwendet, welche die Carboxylgruppe aktivieren und so die Verknüpfung bei milden Bedingungen erleichtern. Es gibt verschiedene Klassen solcher Kopplungsreagenzien [4]:
- Phosphonium-Reagenzien (z. B. BOP)
- Uronium-Reagenzien (z. B. HBTU, HATU)
- Immonium-Reagenzien
- Carbodiimid-Reagenzien (z. B. DCC)
- Imidazolium-Reagenzien
- Organophosphorige Reagenzien
- Saure halogenierende Reagenzien
- Chloroformate und andere
Neben dieser Art der chemischen Synthese werden heute meist Festphasensynthesen angewendet. Zudem können auch Enzyme zur Peptidsynthese eingesetzt werden.
Einzelnachweise
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 1-505, 1982, ISBN 3-527-25892-2
- ↑ E. Fischer, Chem. Z. 26 (1902), S. 939 f.
- ↑ K.P.C. Vollhardt, N.E. Schore:Organische Chemie, 4ed, Wiley-VCH, S. 1399–1402, 2005
- ↑ S.Y.Han, Y.A.Kim, Tetrahedron, 60, S. 2447–2467, 2004
Siehe auch
Weblinks
Wikimedia Foundation.