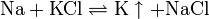- Potassium
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Kalium, K, 19 Serie Alkalimetalle Gruppe, Periode, Block 1, 4, s Aussehen silbrig weiß CAS-Nummer 7440-09-7 Massenanteil an der Erdhülle 2,4 % Atomar Atommasse 39,0983 u Atomradius (berechnet) 220 (243) pm Kovalenter Radius 196 pm Van-der-Waals-Radius 275 pm Elektronenkonfiguration [Ar] 4s1 Elektronen pro Energieniveau 2, 8, 8, 1 Austrittsarbeit 2,3 eV 1. Ionisierungsenergie 418,8 kJ/mol Physikalisch Aggregatzustand fest Kristallstruktur kubisch raumzentriert Dichte 0,856 g/cm3 Mohshärte 0,4 Schmelzpunkt 336,53 K (63,38 °C) Siedepunkt 1032 K (759 °C) Molares Volumen 45,94 · 10−6 m3/mol Verdampfungswärme 79,87 kJ/mol Schmelzwärme 2,334 kJ/mol Dampfdruck 1,06 · 10−4 Pa bei __ K Schallgeschwindigkeit 2000 m/s bei 293,15 K Spezifische Wärmekapazität 757 J/(kg · K) Elektrische Leitfähigkeit 13,9 · 106 A/(V · m) Wärmeleitfähigkeit 102,4 W/(m · K) Chemisch Oxidationszustände 1 Oxide (Basizität) K2O (stark basisch) Normalpotential −2,92 V (K++ e− → K) Elektronegativität 0,82 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 38K 7,636 min ε 5,913 38Ar 39K 93,26 %
Stabil 40K 0,012 %
1,277 · 109 a β− 1,311 40Ca ε 1,505 40Ar β+ 1,505 40Ar 41K 6,73 %
Stabil 42K 12,36 h β− 3,525 42Ca 43K 22,3 h β− 1,815 43Ca NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [1] 

Leicht-
entzündlichÄtzend (F) (C) R- und S-Sätze R: 14/15-34 S: (1/2)-8-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Kalium, (von Kali aus arab. القَلْيَه al qalja „Pflanzenasche“) ist ein chemisches Element der 1. Hauptgruppe des Periodensystems mit der Ordnungszahl 19.
Inhaltsverzeichnis
Geschichte
Kalium unter THFAm 19. November 1807 berichtete Humphry Davy vor der Royal Society in London, es sei ihm gelungen, durch Elektrolyse von schwach angefeuchteten Ätzalkalien zwei verschiedene Metalle zu gewinnen; das eine, am 6. Oktober 1807 erstmals gewonnene, Metall nannte er Potassium (= englische und französische Bezeichnung für Kalium), weil man es aus Pottasche gewinnen kann, das andere, wenige Tage später erstmals gewonnene, Sodium (die noch heute geltende französische und englische Bezeichnung für Natrium), weil es in den verschiedenen Modifikationen von Natriumcarbonat (Soda) enthalten ist. Im deutschen Sprachraum wird das Sodium Davys seit 1811 nach einem Vorschlag von Berzelius als Natrium bezeichnet, während man für das Potassium Davys den von Klaproth 1796 eingeführten Ausdruck Kalium (von arab.: القَليَه al qalja = Asche, aus Pflanzenasche gewinnbar) übernahm.
Vorkommen
Kalium kommt in der Natur nur als Kation in Kaliumverbindungen vor. Das liegt daran, dass es nur ein Außenelektron besitzt und dieses sehr bereitwillig abgibt, um eine stabile und energiearme äußere Elektronenschale zu erlangen. Kovalente Kaliumverbindungen sind daher nicht bekannt. Im Meerwasser liegt die durchschnittliche Konzentration bei 399,1 mg K+/kg = 408,4 mg K+/l.
Natürlich vorkommende kaliumhaltige Minerale sind:
- Sylvin - KCl
- Sylvinit - KCl · NaCl
- Carnallit - KCl · MgCl2 · 6 H2O
- Kainit - KCl · MgSO4 · 3 H2O
- Schönit - K2SO4 · MgSO4 · 6 H2O
- Polyhalit - K2SO4 · MgSO4 · MgSO4 · 2 CaSO4
- Orthoklas (Kalifeldspat) – K[AlSi3O8]
- Muskovit (Kaliglimmer) – KAl2(OH,F)2[AlSi3O10]
Gewinnung und Darstellung
Die Herstellung von metallischem Kalium kann nach mehreren Verfahren erfolgen. Genutzt wurden elektrolytische Verfahren wie das Degussa-Verfahren oder ein thermisches Verfahren der IG Farbenindustrie AG, Werk Griesheim. Das meiste Kalium wird jedoch nach dem MSA-Verfahren der Mine Safety Appliances Co. hergestellt.
Grundlegende Reaktion des in den 1950er Jahren eingeführten MSA-Verfahrens ist die Reduktion des Ausgangsstoffes Kaliumchlorid durch metallisches Natrium bei 870 °C und anschließender Abdestillation des Kaliums aus dem entstandenen Natrium-Kalium-Gemisch.
Durch Variation der Destillationsparameter sind auch handelsübliche NaK-Legierungen zugänglich.
Eigenschaften
Analog den anderen Alkalimetallen reagiert Kalium mit vielen anderen Elementen und Verbindungen oft sehr heftig, insbesondere mit Nichtmetallen, und kommt in der natürlichen Umwelt nur in gebundener Form vor. Es ist reaktionsfreudiger als Natrium. Kalium reagiert heftig mit Wasser unter Bildung von Kaliumhydroxid und Freisetzung von Wasserstoff. Aufgrund der stark exothermen Reaktion entzündet sich der Wasserstoff bei Luftzutritt. Hierbei kann es zu Verpuffungen und Explosionen kommen. In trockenem Sauerstoff verbrennt das Metall mit intensiver violetter Flamme zu Kaliumhyperoxid KO2 und Kaliumperoxid K2O2. An feuchter Luft reagiert es sehr rasch mit Wasser und Kohlenstoffdioxid zu Kaliumcarbonat unter Wasserstoffbildung. In flüssigem Ammoniak ist Kalium, wie alle Alkalimetalle, unter Bildung einer blauvioletten Lösung gut löslich. Mit den Halogenen Brom und Iod in flüssiger oder fester Form setzt sich Kalium explosionsartig zu den entsprechenden Halogeniden um.
Zur Entsorgung von Kalium wird meist das vorsichtige Einbringen kleiner Stücke des Metalls in einen großen Überschuss an tert-Butylalkohol empfohlen, mit dem es unter Bildung des Alkoholats und Wasserstoff reagiert. Da diese Reaktion recht langsam verläuft, kann es passieren, dass unbemerkt kleine, mit einer Kruste von Kalium-tert-butylat umhüllte Kaliumreste übrigbleiben. Daher muss sorgfältig auf die Vollständigkeit der Reaktion geachtet werden. Alternativ kann man für kleine Kaliummengen auch 1-Butanol verwenden, das mit dem Kalium zwar schneller, aber dennoch kontrollierbar reagiert. Keinesfalls sollten „niedrigere“ Alkohole (Propanole, Ethanol oder Methanol) verwendet werden, da diese zu heftig mit Kalium reagieren und zudem leichter entzündlich sind.
An der Luft überzieht sich die silberweiß glänzende Schnittfläche des frischen Metalls innerhalb von Sekunden mit einer bläulich schimmernden Schicht aus Oxid und Hydroxid und ein wenig Carbonat. An der Luft stehengelassen reagiert es wie alle Alkalimetalle langsam vollständig zum Carbonat. Metallisches Kalium wird deshalb unter organischen Flüssigkeiten, die kein Wasser enthalten, wie z.B. Paraffinöl aufbewahrt. Im Gegensatz zu Natrium kann Kalium bei längerer Lagerung dennoch Krusten aus Oxiden, Peroxiden und Hydroxiden bilden, die das Metall in Form rötlich-gelber Schichten überziehen und die bei Berührung oder Druck explodieren können. Eine sichere Entsorgung ist dann nicht mehr möglich, hier bietet sich nur noch der Abbrand des kompletten Gebindes unter kontrollierten Bedingungen an. [2]
Verwendung
Kalium wird hauptsächlich in schnellen Brütern in Form einer Na-K-Legierung als Kühlflüssigkeit eingesetzt. Ansonsten hat metallisches Kalium nur geringe technische Bedeutung, da es durch das billigere Natrium ersetzt werden kann.
Im Forschungslabor wird Kalium gelegentlich zur Trocknung von Lösungsmitteln eingesetzt, besonders, wenn der Siedepunkt des Lösungsmittels über dem Schmelzpunkt des Kaliums, aber unter dem Schmelzpunkt von Natrium liegt. Dann liegt das Kalium im siedenden Lösungsmittel geschmolzen vor und seine Oberfläche verkrustet nicht. Man benötigt somit deutlich weniger Alkalimetall und es kann fast völlig beim Trocknungsprozess verbraucht werden, so dass nur sehr kleine Reste entsorgt werden müssen.
Achtung! Kalium entwickelt beim langen Stehenlassen auch unter Schutzflüssigkeit (Petroleum) Krusten von Peroxoverbindungen (K2O2 und KO2), die sehr brisant reagieren. Bereits durch geringen Druck, insbesondere beim Herausheben von Kaliumstücken mit einer Zange oder beim Versuch des Schneidens mit dem Messer, können diese Peroxoverbindungen Explosionen auslösen. Als Gegenmaßnahmen empfehlen sich entweder das Einschmelzen in Glasampullen oder ein Lagern unter Schutzflüssigkeit und Inertgas. Weiterhin dürfen halogenierte Lösemittel keinesfalls mit Kalium getrocknet werden. Ebenfalls Explosionsgefahr! Auch ist bei Lösemitteln, die leicht Sauerstoff abgeben können, größte Vorsicht geboten!- Dotierung von Wolframdrähten zur Herstellung von Glühlampenwendeln
- NaK Wärmelegierung (Siehe Natrium)
- In Form von Kaliumhyperoxid KO2 als Kaliumluftfilter (Kalipatronen) u. a. auf U-Booten zur Atemluftregenerierung im Einsatz
Biologische Bedeutung
Bedeutung als Düngemittel
Wasserlösliche Kaliumsalze werden als Düngemittel verwendet, da Pflanzen die im Boden vorkommenden Kaliumsilicate schlecht aufschließen können.
Kalium erhöht die Wasseraufnahme der Pflanzenzellen (durch eine Erhöhung des osmotischen Drucks) und sorgt für eine bessere Ausnutzung von Wasser und Nährstoffen. Kalium ist an der Regulation der Spaltöffnungen (Stomata) beteiligt und sorgt für eine bessere Frosttoleranz. Bei Kalium-Mangel leiden Pflanzen auch leicht an Wassermangel und kümmern, im späteren Stadium kommt es zu Chlorosen und Nekrosen älterer Blätter. Ein stärkerer Überschuss bewirkt Wurzelverbrennungen und Ca- bzw. Mg-Mangel.
Kalium ist der Gegenspieler von Calcium - beide Nährelemente müssen also in einem richtigen Verhältnis zueinander in der Pflanze und im Boden vorhanden sein.
Wichtige kaliumhaltige Düngemittel:
- Kornkali mit MgO
- Patentkali
- Kaliumsulfat
- Flory
- Nitrophoska
- Kaliphosphat
- Kalinitrat
Bedeutung für den Körper
Kalium ist ein essentieller Mineralstoff, der tägliche Bedarf des Menschen liegt bei ungefähr zwei Gramm. Kaliumreiche Lebensmittel sind u. a. Pilze, Bananen, Datteln, Bohnen, Chilies, Käse, Spinat und Kartoffeln, in denen es mit rund 0,4 g Kalium/100 g Lebensmittel vorkommt.[3]
Im Körper spielt Kalium eine herausragende Rolle bei der Regulation des Membranpotentials. Die intrazelluläre Kaliumkonzentration liegt bei ungefähr 150 mmol/l, extrazellulär finden sich 4 mmol/l. Die Konzentration an Natrium liegt intrazellulär bei ca. 10 mmol/l, extrazellulär bei 140 mmol/l. Diese Konzentrationsunterschiede werden durch die Na/K-ATPase aufrecht erhalten und sind für die Funktion der Zelle lebenswichtig. Ein dauerhaftes Verschieben dieser zellulären Konzentrationen kann bei erhöhter K+-Konzentration (Hyperkaliämie) d. h. K+ >>4,5 mmol/l zu Herzstillstand in Systole führen. Bei Hypokaliämie, (K+ <3,5 mmol/l): Abnahme der Kontraktionsfähigkeit der Muskeln, erhöhte Erregung, Störung der Erregungsleitung, Extrasystolen des Herzens. K+ ist entscheidend (neben Na+) für den osmotischen Druck der Zellen, d. h. für den Wassergehalt der Zelle. Zu geringe K+-Konzentration im Blut führt zu Herzstillstand in Diastole. Normbereich im Serum: 3,6–5,4 mmol/l, im Harn: 26–123 mmol/l. D. h., es wird ständig K+ verloren und muss mit der Nahrung ersetzt werden, was aber kein Problem ist.
Die in den USA zu Hinrichtungen verwendete Giftspritze enthält Kaliumchlorid, welches zu einer Lähmung der Herzmuskulatur und damit zum Tode führt.
Kalium gehört zu den wichtigsten Elektrolyten der Körperflüssigkeit und ist für die Steuerung der Muskeltätigkeit mitverantwortlich. Bei Leistungssportlern kann es durch übermäßiges Ausschwitzen von Kalium zu Krämpfen und Erschöpfungszuständen kommen.
Weitere Informationen zu körperlichen Auswirkungen von Kalium: Kaliummangel (Hypokaliämie)
Radioaktivität
Kalium besteht zu 0,012 % aus dem radioaktiven Isotop 40K und hat daher eine spezifische Aktivität von 31.200 Becquerel pro Kilogramm. Fast 10 % der natürlichen radioaktiven Belastung eines deutschen Bundesbürgers werden durch körpereigenes Kalium verursacht (0,17 mSv/a zu 2,1 mSv/a) [4].
Der Zerfall von 40K zu 40Ar und 40Ca kann auch zur Altersbestimmung mittels Kalium-Argon-Datierung verwendet werden.
Kaliumnachweis
Neben dem spektroskopischen Nachweis kann man in Wasser gelöste Kaliumionen potentiometrisch mit ionenselektiven Elektroden nachweisen. Die meisten Kaliumelektroden nutzen die spezifische Komplexierung von Kalium durch Valinomycin C54H90N6O18, welches in einer Konzentration von etwa 0,7 % in eine Kunststoffmembran eingebettet ist.
Ein qualitativer Kaliumnachweis ist mittels Perchlorsäure möglich. Es bildet sich das in der Kälte in Wasser schwer lösliche Kaliumperchlorat als weißer Niederschlag.
Quantitativ lässt sich Kalium mit Hilfe der Gravimetrie bestimmen. Hierbei wird Kalium als Tetraphenylborat durch Versetzen der Lösung mit Kalignost gefällt und der erhaltene Niederschlag ausgewogen.
Weitere Nachweise sind mittels Kaliumnatriumhexanitrocobaltat(III), Kaliumhydrogentartrat(KA=3,80 · 10−4) und Kaliumhexachloroplatinat(IV) möglich.
In der Routineanalytik (Klinische Chemie (Blut), Umweltchemie, Wasserchemie) wird Kalium bis in den Spurenbereich mit der Flammenphotometrie quantitativ bestimmt. Als Bestimmungsgrenze wird hier 100 µg/l genannt.[5] In der Atomabsorptionsspektrometrie ist mit der Flammentechnik noch 1 µg/l nachweisbar, mit der Graphitrohrtechnik 0,004 µg/l.[6]
Verbindungen
In seinen Verbindungen kommt Kalium nur als 1-wertiges Kation vor:
- Kaliumbromid
- Kaliumcarbonat (Pottasche)
- Kaliumchlorat
- Kaliumchlorid
- Kaliumchromat
- Kaliumcyanid
- Kaliumdichromat
- Kaliumdihydrogenphosphat
- Kaliumfluorid
- Kaliumhydrid
- Kaliumhydrogenphosphat
- Kaliumhydroxid
- Kaliumhyperoxid
- Kaliumiodat
- Kaliumiodid
- Kalium-Natrium-Tartrat (Seignette-Salz)
- Kaliumniobat
- Kaliumnitrat
- Kaliumoxid
- Kaliumperchlorat
- Kaliumpermanganat
- Kaliumphosphat
- Kaliumpolysulfid
- Kaliumpropionat
- Kaliumsulfat
- Kaliumthiocyanat
- Kaliumhexacyanoferrat(II)
- Kaliumhexacyanoferrat(III)
Einzelnachweise
- ↑ Eintrag zu CAS-Nr. 7440-09-7 im European chemical Substances Information System ESIS
- ↑ Freie Universität Berlin Instituts für Chemie und Biochemie Entsorgung von Kalium
- ↑ Bayerische Landesanstalt für Landwirtschaft
- ↑ Bundesamt für Strahlenschutz
- ↑ K. Cammann (Hrsg.), Instrumentelle Analytische Chemie, Spektrum Akademischer Verlag, Heidelberg-Berlin, 2001, S. 4-60.
- ↑ K. Cammann (Hrsg.), Instrumentelle Analytische Chemie, Spektrum Akademischer Verlag, Heidelberg-Berlin, 2001,S. 4-47.
Weblinks
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.