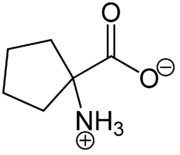
- 1-Aminocyclopentan-1-carbonsäure
-
Strukturformel 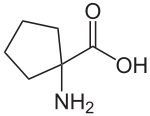
Allgemeines Name Cycloleucin Andere Namen - 1-Aminocyclopentan-1-carbonsäure
- 1-Aminocyclopentancarbonsäure
Summenformel C6H11NO2 CAS-Nummer 52-52-8 PubChem 2901 DrugBank DB04620 Eigenschaften Molare Masse 129,16 g·mol-1 Aggregatzustand fest
Schmelzpunkt 320 °C [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: 22-24/25 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cycloleucin ist eine nichtproteinogene α-Aminosäure und kann als cyclisches Derivat des Norleucins aufgefasst werden. Von diesem unterscheidet es sich u. a. durch eine um zwei Wasserstoffatome geringere Molmasse. Bestimmendes Strukturelement ist ein Cyclopentanring. Das α-Kohlenstoffatom ist zudem kein Stereozentrum, Cycloleucin ist also nicht chiral.
Inhaltsverzeichnis
Eigenschaften
Ähnlich, wie andere Aminosäuren liegt Cycloleucin überwiegend als Zwitterion vor, dessen Bildung formell dadurch zu erklären ist, dass das Proton der Carboxylgruppe an das freie Elektronenpaar des Stickstoffatoms der Aminogruppe wandert.
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Cycloleucin auch seine geringste Löslichkeit in Wasser hat.
Synthese
Die basische Hydrolyse des Heterocyclus Cyclopentanspiro-5'-hydantoin mit anschließender Neutralisation mit Salzsäure liefert Cycloleucin.[2] Die Cyclisierung von NCCH2CO2C2H5 mit 1,4-Dibrombutan in Gegenwart von Natriumhydrid liefert 1-Isonitrilocyclopentancarbonsäureethylester. Saure Hydrolyse mit alkoholischer Salzsäure und Neutralisation mit alkoholischer Natronlauge führt dann zu Cycloleucin.[3] Alternative Synthesemethoden sind in einer anderen Arbeit beschrieben.[4]
Verwendung
Cycloleucin ist eine nichtmetabolisierbare Aminosäure und ein spezifischer und reversibler Inhibitor von Enzymen, die Nucleinsäuren methylieren.[5] Daher kann es vielfältig in biochemischen Experimenten eingesetzt werden.
Einzelnachweise
- ↑ a b Daten der Firma Sigma-Aldrich.
- ↑ P. Tailleur, L. Berlinguet: "Synthesis of short peptides containing 1-aminocycloalkanecarboxylic acid", in: Canadian Journal of Chemistry 1961, 37, 1309–1320.
- ↑ D. Kalvin, K. Ramalingam, R. Woodard: "A facile procedure for the preparation of alicyclic α-amino acids", in: Synthetic Communications 1985, 15 (4), 267–272; doi:10.1080/00397918508063798.
- ↑ S. S. Lin, J. Y. Liu, J. M. Wang: "The synthesis of cyclic amino acids", in: Chinese Chemical Letters 2003, 14 (9), 883–884; PDF.
- ↑ M. Caboche, J. P. Bachellerie: "RNA methylation and control of eukaryotic RNA biosynthesis. Effects of cycloleucine, a specific inhibitor of methylation, on ribosomal RNA maturation", in: European Journal of Biochemistry 1977, 74 (1), 19–29; PMID 856572.
Siehe auch
Wikimedia Foundation.