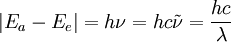- Quantenhafte Absorption
-
Der Franck-Hertz-Versuch, welcher zuerst in den Jahren 1911 – 1914 von James Franck und Gustav Ludwig Hertz durchgeführt wurde, belegt die Existenz von diskreten Energieniveaus in Atomen. Dadurch wurde das bohrsche Atommodell gestützt und zur Fortentwicklung der Quantenphysik beigetragen, den Experimentatoren wurde für diesen Versuch 1925 der Nobelpreis in Physik verliehen.
Im Versuch stoßen Atome mit Elektronen, die in einem elektrischem Feld beschleunigt wurden, zusammen. Ergänzt durch spektroskopische Untersuchungen des beim Versuch von den Atomen emittierten Lichtes zeigt der Versuch, dass in Atomen Energieaufnahme und -abgabe nur in Form diskreter Energiepakete (Quanten) erfolgt.
Der Franck-Hertz-Versuch gehört zu den eindrucksvollsten Belegen der Quantenphysik und ist gleichzeitig relativ einfach aufgebaut. Er ist deshalb ein beliebter Demonstrations- und Praktikumsversuch in der Physikausbildung.
Inhaltsverzeichnis
Einordnung
Zu Beginn des 20. Jahrhunderts war durch spektroskopische Untersuchungen (z. B. Emissionslinien von Gasen, Absorptionslinien wie die bekannten Fraunhoferlinien oder die Resonanzfluoreszenz) und durch Phänomene wie dem Photoeffekt bekannt, dass der Energieaustausch zwischen Licht und einzelnen Elektronen oder Atomen in diskreten Energiepaketen erfolgt.
1913 hatte Niels Bohr das nach ihm benannte Atommodell vorgestellt und so das Linienspektrum des Wasserstoffs erklärt (z. B. die schon länger bekannten Linien der Balmer-Serie). Die Energieaufnahme oder -abgabe der Atome erfolgt nach dieser halbklassischen Theorie als Absorption oder Emission von Lichtquanten, deren Größe durch die Differenz je zweier solcher Energieniveaus gegeben ist. Durch die bohrsche Frequenzbedingung ist ein Zusammenhang zwischen der Anregungsenergie ΔE eines Atoms und der Emission einer Spektrallinie der Wellenlänge λ gegeben:
wobei
- Ea der Energie des Anfangszustandes,
- Ee der Energie des Endzustandes,
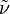 der Wellenzahl (
der Wellenzahl (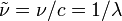 ),
),- ν der Frequenz der Spektrallinie und
- h dem planckschen Wirkungsquantum (6,626·10-34Js) entspricht.
Die Methode des Franck-Hertz-Versuchs, die Anregung des Atoms auf ein höheres Energieniveau statt mit Licht durch einen unelastischen Stoß mit Elektronen zu realisieren, ermöglichte eine eindrucksvolle Bestätigung dieses Zusammenhangs. Daneben kann experimentell die niedrigste Anregungsenergie der Atome bestimmt werden.
Die Experimentatoren gingen in der Originalveröffentlichung (1914) allerdings noch davon aus, mit Ihrem Versuch die Ionisierungsenergie des betrachteten Quecksilbergases bestimmt zu haben und konnten erst später die Tragweite Ihres Experiments überblicken[1].
Franck-Hertz-Versuch
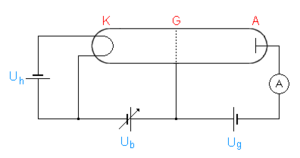
Versuchsanordnung und Durchführung
In einem Glaskolben befindet sich ein Gas (meist Quecksilberdampf, aber auch Neon ist üblich) mit niedrigem Druck, typischerweise im Bereich von 10 bis 20 mbar. Auf einer Seite des Glaskolbens befindet sich eine geheizte Glühkathode K, die durch die regelbare Spannung Ub etwas negativer als das Gitter G geladen wird. Wenige Millimeter hinter dem Gitter befindet sich eine Platte A, die gegenüber dem Gitter ein leicht negatives Potential von etwa 1 V besitzt.
Sinn dieser Anordnung ist, Elektronen zwischen K und G zu beschleunigen und mit den Quecksilberatomen zusammenstossen zu lassen. Mit dem schwachen Gegenfeld zwischen G und A wird dann gemessen, wie viele Elektronen beim Durchtritt durch G noch eine gewisse Mindestenergie besitzen.
Die von der Kathode emittierten Elektronen werden durch das elektrische Feld zwischen Kathode und Gitter beschleunigt und erreichen am Gitter ihre höchste Geschwindigkeit. Die meisten Elektronen landen auf dem Gitter und werden wegen Ub wieder zur Kathode zurück transportiert. Wenige passieren das Gitter und werden vom elektrischen Feld zwischen Gitter und Platte A abgebremst (sogenannte Gegenfeldmethode). Der Strom zwischen Kathode und Platte wird mit Hilfe eines empfindlichen Amperemeters gemessen.
Beobachtung
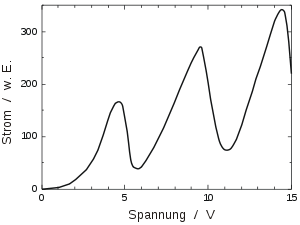
Erhöht man die Spannung Ub, wachsen die gemessenen Stromwerte zunächst an. Ab einem bestimmten (von der Gasfüllung abhängigen) Spannungswert fällt der Strom ab, erreicht einen Minimalwert und steigt dann wieder an. Etwa bei dem doppelten Wert der Spannung, bei der der Strom zum ersten Mal sinkt, fällt er erneut ab und steigt danach wiederum an. Dies wiederholt sich periodisch, dabei steigt die Stromstärke jedes Mal auf einen höheren Wert. Die Abstände zwischen den Maxima bzw. Minima sind – im Gegensatz zu vielen Darstellungen – allerdings nur näherungsweise konstant[2].
Dieses Änderungsverhalten der Stromstärke zeigt sich nicht beim Kathodenstrom bzw. Gitterstrom. Diese Stromstärke steigt mit der Spannung an bis – abhängigig vom Gasdruck (bei Quecksilber etwa 40 V) – eine Gasentladung zündet. Um eine Zerstörung der Röhre durch die schlagartig erhöhte Stromstärke zu vermeiden, wird im Versuchsaufbau deshalb in Reihe zu Ub ein hochohmiger Widerstand angelegt.
Erklärung
Der zu beobachtende Abfall der Stromstärke entspricht einer drastisch kleiner werdenden Zahl von zur Platte "durchkommenden" Elektronen. Das hängt damit zusammen, dass die Elektronen, sobald sie eine bestimmte Energie (bei Quecksilber ca. 4,9 eV) besitzen, beim Stoß mit den Atomen des Füllgases kinetische Energie, bei Quecksilber eben diese 4,9 eV, abgeben können. Das getroffene Atom wird bei diesem unelastischen Stoß angeregt, d. h. im bohrschen Atommodell nimmt ein Hüllenelektron die abgegebene Energie auf und springt auf eine höhere Schale. Da dieser Zustand instabil ist, fällt es unter Emission eines Lichtquants kurze Zeit später zurück in den Grundzustand. Zunächst steigt der Strom, weil das beschleunigende Feld stärker wird und mehr emittierte Elektronen die Gegenspannung überwinden, die zwischen Gitter und der Auffangplatte besteht. Dabei erfolgen offensichtlich nur elastische Stöße zwischen den Elektronen und den Gasteilchen, d. h. es kann kein Energieübertrag vom Elektron auf das Atom erfolgen. Wenn die Spannung die Elektronen stark genug beschleunigt, führen sie unelastische Stöße mit den Atomen aus und geben dabei Energie ab. Daher haben weniger von ihnen eine ausreichende kinetische Energie, um das abbremsende Feld zu überwinden. Der gemessene Strom nimmt somit ab. Er sinkt jedoch nicht wieder bis auf 0 Ampere, weil niemals alle Elektronen mit den Atomen zusammenstoßen. Beim Erhöhen der Beschleunigungsspannung werden auch die Elektronen, die beim Stoß Energie abgeben, wieder stark genug weiterbeschleunigt, sodass die Zahl der Elektronen, die die abbremsende Spannung überwinden, wieder größer wird, bis die beschleunigende Spannung die Elektronen so stark beschleunigt, dass sie ein zweites Mal die erforderlichen 4,9 eV an ein Gasteilchen abgeben können. Nun existiert nicht nur eine Zone leuchtenden Quecksilbergases, es gibt zwei voneinander getrennte Zonen. Das von den Quecksilberatomen emittierte Licht (der Energie 4,9 eV) ist mit einer Wellenlänge von ca. 253 nm allerdings im ultravioletten Bereich und damit nicht sichtbar.
Erweiterungen des Versuchs
Verbesserte Auflösung mit elektrischer „Lupe“
Die einfache Schaltung des vorhergehenden Kapitels unterscheidet nicht zwischen Beschleunigungs- und Reaktionsstrecke der Elektronen und liefert deshalb nur Information über das unterste freie Energieniveau der Gasatome. Durch die Einführung eines zweiten Gitters gelingt es, auch höhere Energiestufen nachzuweisen.
Dazu wählt man den Abstand zwischen der Kathode und dem Gitter 1 sehr klein, damit die Elektronen kaum unelastische Stöße mit Gasatomen ausführen, wenn sie durch UG1 (etwa 10 V) fast auf die notwendige Energie für höhere Niveaus beschleunigt werden. Zwischen Gitter 1 und Gitter 2 werden sie auf viel größerer Distanz durch eine erheblich geringere Spannung ΔU (der Größenordnung 0,1 V) nachbeschleunigt, wodurch sich ihre Geschwindigkeit nur allmählich steigert.
Falls Gasatome mit passenden Energieniveaus vorhanden sind, ist es sehr wahrscheinlich, dass es zu unelastischen Stößen von Elektronen mit ihnen kommt, was diese Elektronen hindert, die anschließende Gegenspannung zwischen Gitter 2 und der Platte A zu überwinden.
Andere Gasfüllungen
Zu didaktischen Zwecken wird der Versuch auch mit Neon anstelle von Quecksilber durchgeführt. Hier sind die Anregungsenergien zwar höher - sie liegen zwischen 18,4 eV und 19,0 eV - die Abregung geschieht jedoch auch über Energiezustände im Bereich zwischen 16,6 eV und 16,9 eV. Daher entstehen auch Photonen geringerer Energie, was zur Lichtemission im sichtbaren Bereich (rot-orange) führt[3]. Entspricht die Spannung mindestens der doppelten Anregungsspannung, so sind in der Röhre mehrere nebeneinander liegende leuchtende Bereiche direkt beobachtbar.
Einzelnachweise
- ↑ J. Franck und G. Hertz: Über Zusammenstöße zwischen Elektronen und Molekülen des Quecksilberdampfes und die Ionisierungsspannung desselben. In: Verh. Dtsch. Phys. Ges.. Nr. 16, 1914, S. 457–467. (Auszüge online auf leifiphysik)
- ↑ G. Rapior, K. Senstock, V. Baev: New features of the Franck-Hertz experiment. In: Amer. J. Phys.. Nr. 74, 2006, S. 423–428. (online (englisch))
- ↑ Termschema in Abbildung FH.2
Weblinks
- LP - Der Franck-Hertz-Versuch auf den Seiten der Universität Göttingen (inkl. Skizzen, Fotos, Videos und Literaturhinweisen)
- Informationen und Animationen auf den Seiten von leifiphysik.
- Interaktive Versuchsdurchführung auf den Seiten der Kansas State University (englisch, benötigt Adobe Shockwave)
Wikimedia Foundation.