- Razemat
-
In der Chemie bezeichnet man als ein Racemat (lat.: acidum racemicum = Traubensäure, mit der die erste Racemat-Trennung gelang; Aussprache allg. als Ra-ze-mat, richtig wäre jedoch Ra-ke-mat) ein äquimolares Gemisch von zwei Enantiomeren. Ein Racemat ist nicht optisch aktiv, d.h. es dreht die Polarisationsebene von polarisiertem Licht nicht, da beide Enantiomere in gleicher Menge vorhanden sind.
Die Unterscheidung, ob eine Verbindung als Racemat oder als eines der Enantiomere vorliegt, ist insofern wichtig, als Enantiomere zwar gleiche physikalische[1], aber oft völlig unterschiedliche physiologische Eigenschaften aufweisen:
- Geruch, Beispiel: D-(+)-Carvon riecht nach Kümmel während L-(–)-Carvon nach Minze riecht.
- Geschmack, Beispiel: D-(–)-Leucin schmeckt süß während L-(+)-Leucin bitter schmeckt.
- Pharmakologie, Beispiel: (S)-konfigurierte β-Blocker (Betarezeptorenblocker) wirken in der Regel 100mal stärker als das (R)-Enantiomer.[2]
Den vollständigen oder anteiligen Abbau eines vorhandenen Enantiomerenüberschusses bezeichnet man als Racemisierung. Die Auftrennung eines Racemats in die einzelnen Enantiomere erfolgt durch Racematspaltung.
Inhaltsverzeichnis
Kristallisation
Man unterscheidet drei verschiedene Arten, in denen ein Racemat kristallisieren kann, dies hat besonders Auswirkungen auf Racematspaltungen durch Kristallisation. H.W.B. Roozeboom hat bereits 1899 klar definiert, wie man zwischen diesen Arten unterscheiden kann.
Racemische Verbindung
Ein kristallines Racemat, das eine einzige Phase bildet, in welcher die zwei Enantiomere wohlgeordnet in einem 1:1 Verhältnis in der Elementarzelle vorkommen, wird racemische Verbindung genannt. Die Mehrheit aller chiralen Verbindungen kristallisiert auf diese Weise.
Konglomerat
Ein Konglomerat ist ein kristallines Racemat, das aus einer Mischung aus separaten Kristallen der reinen Enantiomere besteht. Dieser kristalline Typ kommt seltener vor als die racemische Verbindung.
Pseudoracemat
Dies ist ein kristallines Racemat, in dem die beiden Enantiomere Mischkristalle bilden[3]. Die Enantiomere liegen im Verhältnis 1:1 vor, sind aber im Kristallgitter statistisch verteilt. Ungleiche Mengen beider Enantiomere können in jedem Verhältnis kokristallisieren. Nur sehr wenige chirale Verbindungen kristallisieren auf diese Weise.
Racematspaltung
Prinzip
Als Racematspaltung werden Verfahren zur Trennung von Racematen in ihre Enantiomere bezeichnet. Auftrennungsprinzipien sind:
- manuelles Sortieren von separat gewachsenen Kristallen ("Pasteur")
- Chromatographie mit einer enantiosektiven Phase[4]
- Bildung diastereomerer Salze durch Zugabe eines enantiomerenreinen Hilfsstoffes und anschließende Trennung durch fraktionierende Kristallisation unter Ausnutzung ihrer unterschiedlichen physikalischen Eigenschaften[5]
- Komplexbildung mit (enantioselektiven) Rezeptoren
- kinetische Trennung (reaktiver Entzug einer Komponente aufgrund unterschiedlicher Reaktivität mit enantioselektiven Reagenzien)
- indirekte Prinzipien: a) temporäres kovalentes Binden an Hilfsstoffe oder b) asymmetrische Synthese innerhalb einer Syntheseroute
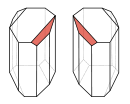
Die klassische Methode nach Louis Pasteur, die allerdings praktisch unbedeutend ist, ist das manuelle Aussortieren von Kristallen unter dem Mikroskop. Eine Voraussetzung dafür ist, dass das Racemat von sich aus Kristalle bildet, die nur eines der Enantiomere enthalten (spontane Spaltung). Solche Kristalle unterscheiden sich auch makroskopisch wie Bild und Spiegelbild.
Die im organisch-chemischen Labor übliche Methode ist das in Kontakt bringen mit chiralen Materialien. Chromatographisch wählt man dazu entweder die mobile (Eluenz) oder die stationäre Phase optisch aktiv. Das führt zur unterschiedlichen Retention zweier Enantiomere. Auch eine dünnschichtchromatographische Enantiomerentrennung unter Verwendung einer enantioselektiven stationären Phase ist bekannt.
Diastereomere Salze haben unterschiedliche physikalische Eigenschaften, wie z.B. Löslichkeit oder Schmelzpunkt, und lassen sich so entsprechend z.B. durch fraktionierte Kristallisation trennen.
Eine weitere Methode ist die kinetische Racematspaltung. Dabei wird eine racemische Substanz mit einem enantiomerenreinen Reagenz zusammen gebracht, wobei ein Enantiomer schneller reagiert als das andere. Ist der Unterschied in der Reaktionsgeschwindigkeit groß genug, bleibt ein Enantiomer unverändert zurück, das andere Enantiomer wird in eine neue (evtl. ebenfalls chirale) Verbindung überführt. Dieses Trennprizip macht man sich z. B. bei der enzymatischen Racematspaltung mit Hydrolasen zu nutze. Die häufiger angewendete Art der kinetischen Racematspaltung bedient sich der Katalyse, bei der anstelle eines Reagens ein enantiomerenreiner Katalysator verwendet wird, der ein Enantiomer des Edukts schneller umsetzt als das andere. Erstmals demonstriert wurde dieses Verfahren ebenfalls durch Pasteur 1858, der die Hefe Penicillium glaucum mit racemischer Weinsäure als Nährstoff wachsen ließ. Während das eine Enantiomer von der Hefe verstoffwechselt wurde, blieb das andere Enantiomer in der Lösung zurück.[6]
Geschichte: Erste Racematspaltung durch Pasteur
Pasteur ließ 1847, im Alter von 25 Jahren, eine wässrige Lösung von racemischem Natrium-Ammonium-Tartrat auskristallisieren und trennte daraus einzelne Kristalle aufgrund ihrer asymmetrischen Form („hemihedrale Flächen“). Eine Lösung der Kristalle einer Sorte zeigte optische Aktivität in die eine, die andere in die entgegengesetzte Richtung – das Racemat war in Enantiomeren getrennt. Man zweifelte Pasteurs Arbeit an und er musste sie unter der Aufsicht von Jean-Baptiste Biot wiederholen, was gelang. Pasteur hatte Glück: Wäre es im Labor kälter gewesen, wäre der Versuch misslungen. Bei Natrium-Ammonium-Tartrat tritt spontane Spaltung nur oberhalb von etwa 18 °C auf (Kristallisation als Konglomerat), darunter wäre nur eine Sorte Kristalle entstanden - die racemische Verbindung.
Siehe auch
Quellen und Anmerkungen
- ↑ gleich, bezüglich ihres Betrags
- ↑ Ernst Mutschler: Arzneimittelwirkungen, 5. Auflage, Wissenschaftlichen Verlagsgesellschaft Stuttgart, 1986, S. 277, ISBN 3-8047-0839-0.
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006
- ↑ Kurt Günther, Jürgen Martens und Maren Schickedanz: Dünnschichtchromatographische Enantiomerentrennung mittels Ligandenaustausch, Angewandte Chemie 96 (1984) 514-515; Angewandte Chemie International Edition in English 23 (1984) 506.
- ↑ Bernd Schäfer: Naturstoffe der chemischen Industrie, Elsevier GmbH, Spektrum Verlag, 2007, Seite 155, ISBN 978-3-8274-1614-8.
- ↑ Pasteur, M. L. (1858): C. R. Hebd. Seances Acad. Sci. 46, 615-618.
Weblinks
- Quarks & Co.: Racematspaltung durch Pasteur
Wikimedia Foundation.