- Regioselektivität
-
Selektivität beschreibt in der Chemie eine Reaktion, bei der von mehreren möglichen Reaktionsprodukten bevorzugt eines gebildet wird.[1]
Inhaltsverzeichnis
Regioselektivität
Bei einer regioselektiven Reaktion werden bestimmte Regionen eines Moleküls bevorzugt angegriffen. Beispielsweise läuft die elektrophile Zweitsubstitution an Aromaten regioselektiv ab. Elektronenspendende Erstsubstituenten bewirken eine bevorzugte Zweitsubstitution in ortho- und para-Stellung, während elektronenziehende Erstsubstituenten eine Zweitsubstitution in meta-Stellung induzieren.
Chemoselektivität
Umsetzungen bei denen das Reagenz im Substrat genau eine Art von mehreren möglichen Transformationen bewirkt, werden als chemoselektiv bezeichnet. Beispielsweise kann ein Reduktionsmittel in einem Edukt, das mehrere Carbonylgruppen enthält, bevorzugt eine bestimmte Gruppe reduzieren, während die übrigen Carbonylgruppen nicht reduziert werden. So läßt sich mit Natriumborhydrid eine Ketogruppe chemoselektiv reduzieren, ohne das eine Estergruppe angegriffen wird.
cis-/trans-Selektivität (E-/Z-Selektivität)
Wenn bei der Synthese eines Alkens das cis-Alken bevorzugt gebildet wird spricht man von einer cis-selektiven Reaktion. Ein Beispiel für eine solche Reaktion ist die heterogen katalysierte Hydrierung von 2-Butin zu cis-2-Buten. Die homogene katalysierte Hydrierung von 2-Butin führt selektiv zu trans-2-Buten. Die Wittig-Reaktion von Aldehyden oder unsymmetrischen Ketonen kann bevorzugt zu cis-Alkenen führen.
Stereoselektivität
Bei stereoselektiven Reaktionen wird von zwei oder mehr möglichen Stereoisomeren jeweils eines bevorzugt gegenüber den anderen gebildet oder umgesetzt.
Diastereoselektivität
Bei diastereoselektiven Reaktionen wird ein Diastereomer von zwei oder mehr möglichen Diastereomeren bevorzugt gebildet. Beispielsweise kann die Reduktion (mit achiralen Reduktionsmitteln) der Carbonylgruppe eines chiralen unsymmetrischen Ketons (Edukt) diastereoselektiv zu einem der beiden möglichen sekundären Alkohole führen. Wenn dabei das als Edukt eingesetzte chiralen unsymmetrischen Keton enantiomerenrein ist entsteht in der Regel ein enantiomerer sekundärer Alkohol bevorzugt. Ist das Edukt jedoch ein Racemat, entsteht unter den gleichen Reaktionsbedingungen mit der gleichen Diastereoselektivität ein racemischer sekundärer Alkohol bevorzugt.
Die Diels-Alder-Reaktion läuft diastereoselektiv ab. Meist ist die Bildung des endo-Produktes gegenüber dem exo-Produkt bevorzugt. Auch bei der [4+2]-Cycloaddition von zwei Molekülen Cyclopentadien ist die Bildung des endo-Dicyclopentadiens bevorzugt.
Enantioselektivität
Bei enantioselektiven Synthesen wird aus einen prochiralen Edukt eines der möglichen beiden Enantiomeren bevorzugt gebildet. Bei der Reduktion der Carbonylgruppe eines chiralen unsymmetrischen Ketons (Edukt) mit enantiomerenreinen Reduktionsmitteln oder in Gegenwart geeigneter enantiomerenreiner Katalysatoren kann enantioselektiv einer der beiden möglichen sekundären Alkohole bevorzugt gebildet werden.[2] Die beiden möglichen Reaktionsübergangszustände sind dabei diastereomer zueinander.
Selektivität in der chemischen Reaktionstechnik
Die Selektivität einer chemischen Umsetzung oder eines Reaktors gibt an, welcher Anteil des insgesamt umgesetzten Ausgangsstoffes unter Berücksichtigung der Stöchiometrie in das gewünschte Zielprodukt umgesetzt wurde. In der Regel setzen sich nicht alle Moleküle zu dem gewünschten Produkt um, da durch Folge oder Konkurrenzreaktionen andere Produkte entstehen können.
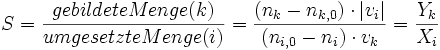
Einzelnachweise
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich, 2006, S. 28, ISBN 978-3-906390-29-1.
- ↑ Sabine Wallbaum und Jürgen Martens : Asymmetric Syntheses with Chiral Oxazaborolidines, Tetrahedron : Asymmetry 3 (1992) 1475-1504.
Siehe auch
- Selektivität (analytische Chemie)
- Isoinversionsprinzip
Wikimedia Foundation.
